همه چیز در مورد سکته های قلبی ( حمله قلبی یا انفارکتوس میوکارد)
تشخیص و درمان درد سینه (به بیان علمی)
مطالب مرتبط:
- معاینه بیماران قلبی عروقی // نوار قلب (الکتروکاردیوگرافی = ECG ) در سکته قلبی // آنزیم های قلبی در سکته قلب
- آترواسکلروز (تصلب شرایین) چیست؟ // درد سینه (آنژین) // پنج علت مهم و کشنده درد سینه
- سکته قلبی به زبان ساده // علت سکته (انفارکتوس ) قلبی
- نارسایی قلبی // کاردیومیوپاتی ها // کاردیومگالی یا بزرگ شدن قلب
- آنژیوگرافی، بالون زدن و تعبیه استنت. // انواع استنت ، // عوارض آنژیوپلاستی درمان اینترونشنال (مداخله ای)
- بالون زدن و گذاشتن استنت PCI یا جراحی باز بای پس قلب CABG کدام درمان ارجح است؟
- جراحی عروق کرونری قلبی (جراحی بای پس قلبی). ، عوارض جراحی باز عروق قلب
- آیا پس از تشخیص وجود تنگی شریان کرونری، همه تنگیها باید تحت مداخله باز کردن با آنژیوگرافی قرار گیرد؟
- آشنایی با عوامل خطر بیماری قلبی
- قلب سالم
- علائم بیماریهای قلبی عروقی
همه چیز در مورد سکته های قلبی ( حملات قلبی یا انفارکتوس میوکارد) به زبان علمی:
این مقاله برای استفاده همکاران پزشک و پیراپزشکی نگارش شده و در صورت ثقیل بودن مقاله “ سکته قلبی به زبان ساده ” را مطالعه فرمایید.
آترواسکلروز یا تصلب شرایین یکی از اصلیترین علل حمله ها و سکته های قلبی میباشد. علیرغم تمام پیشرفتها در علم پزشکی و تسهیل تشخیص و درمان بیماریهای قلبی و عروقی، متاسفانه هنوز هم شیوع این بیماریها در کشور ما رو به افزایش بوده و بعد از یک سیر افزایش یابنده تا سال ۲۰۲۰ به حداکثر رسیده و سپس امید میرود شیوع آن کاهش
یابد.
یابد.
درد سینه علت شایعی برای مراجعه بیماران به اورژانس بوده و با توجه به افزایش شیوع حمله ها و سکته های قلبی و نیز کاهش سن ابتلا به آن ، به یک دغدغه و نگرانی در بیماران تبدیل شده است.
همچنین هر چند کمتر از تنها یک سوم از بیماران با درد حاد قفسه سینه، واقعاً مشکل مهمی دارند اما با توجه به تشخیص های مهم و وخیم تهدید کننده حیات مانند سندرم حاد کرونری (انفارکتوس یا سکته قلبی)، آمبولی ریه (لخته داخل شریان ریه معادل سکته ریوی)، دایسکشن آئورت ( پرگی ناگهانی رگ اصلی بدن)، پنوموتراکس خودبخودی (پاره شدن الوئول ریه و تجمع هوا در بیرون ریه) و پریکاردیت یا تامپوناد( تجمع مایع اطراف قلب و غرق شدن قلب) با توجه به کشنده بودن تمام تشخیص های فوق به یک چالش تشخیصی و با توجه به لزوم شروع فوری و اورژانسی درمان در هر مرکز اولیه، به یک چالش درمانی برای تمام بیماران و پزشکان تبدیل شده است.
آترواسکلروز یک پدیده مزمن و پیشرونده با سیر آهسته با شروع از حوالی ۲۰ سالگی میباشد.
در اوایل، شروع و پیشرفت آترواسکلروز کاملا بدون علامت بوده و تا وقتی حداقل حدود ۶۰ درصد قطر رگ مسدود نشده است معمولا بیمار علائم بالینی حتی حین فعالیتهای متوسط تا شدید ندارد. با افزایش درصد انسداد بتدریج علائم درفعالیتهای شدید ظاهر شده و در صورت عدم درمان بتدریج علائم بیمار با سطح فعالیت کمتر ایجاد خواهد شد. به این شرایط بیماری ایسکمیک پایدار یا همان آنژین مزمن پایدار گویند.
علارغم انسداد عروق کروزی یا محیطی در این شرایط، اما با توجه به ماهیت پایدار پلاک آترواسکلروز، درد همیشه با سطح تقریبا ثابت و معینی از فعالیت ایجاد شده و هیچگاه درد استراحتی نخواهیم داشت. این شرایط شیوع نسبتاً بالایی در جامعه داشته و بیشتر افراد مسن به درجاتی درگیر این فرم پایدار آترواسکلروز میباشند اما با توجه به ماهیت پایدار آن و سیر تدریجی افزایش یابنده (با حتی سیر کاهش یابنده با درمانهای دارویی و تغییر روش زندگی)، معمولا مشکل عمده و ناگهانی در زندگی ایجاد نمیکند.
اما بیشترین ترس پزشکان از این شرایط، احتمال پاره شدن این پلاک ها و تشکیل ترومبوس در اطراف پلاک پاره شده میباشد. در چنین شرایطی بیمار درد استراحتی یا درد فعالیتی جدیداً شروع شده بیان میکند یا از تشدید درد فعالیتی قبلی با سطح فعالیت کمتر یا نیاز به داروهای وازوردیلاتور بیشتر مثل نیتراتها را ذکر میکند که بعنوان سندرم حاد کرونری با طیف تشخیصی آنژین ناپایدار تا انفارکتوس میوکارد را شامل می شود.
اما بیشترین ترس پزشکان از این شرایط، احتمال پاره شدن این پلاک ها و تشکیل ترومبوس در اطراف پلاک پاره شده میباشد. در چنین شرایطی بیمار درد استراحتی یا درد فعالیتی جدیداً شروع شده بیان میکند یا از تشدید درد فعالیتی قبلی با سطح فعالیت کمتر یا نیاز به داروهای وازوردیلاتور بیشتر مثل نیتراتها را ذکر میکند که بعنوان سندرم حاد کرونری با طیف تشخیصی آنژین ناپایدار تا انفارکتوس میوکارد را شامل می شود.
پس سندرم حاد کرونری با طیف تشخیص از آنژین ناپایدار تاانفارکتوس (حمله یا سکته ) قلبی بصورت یکی از تعاریف زیر تعریف میشود.
۱- شروع درد سینه (آنژین) فعالیتی جدید (در طی ۴ تا ۶ هفته اخیر)
۱- شروع درد سینه (آنژین) فعالیتی جدید (در طی ۴ تا ۶ هفته اخیر)
۲- درد سینه (آنژین) استراحتی در هر زمان
۳- تشدید درد سینه (آنژین) قبلی (شروع درد با فعالیت کمتر یا افزایش اخیر نیاز به نیترات و دارو)
با توجه به اهمیت درد سینه در مراجعه به اورژانس، در این مقاله برآنیم تا ضمن بررسی نحوه تشخیص و درمان سندرم حاد کرونری، نگرش جدید در مورد پدیدههای آترواسکلروز در بیماران ایجاد نمائیم.
درد حاد قفسه سینه یکی از شایعترین علل مراجعه به بخش اورژانس میباشد. این تظاهر میتواند معرف سکته قلبی (سندرم حاد کرونری (ACS=acute coronary syndrome )) باشد. البته بعد از ارزیابیهای تشخیصی، تنها ۳۰-۱۵% از بیماران با درد حاد قفسه سینه، واقعاً سکته قلبی (سندرم حاد کرونری) دارند. گاهی افتراق بیماران دچار سکته قلبی با دیگر موقعیتهای تهدید کننده حیات (آمبولی ریه، دایسکشن آئورت ، پنوموتراکس خودبخودی و پریکاردیت یا تامپوناد) ، از بیماران دچار درد قفسه سینه غیر قلبی و غیر تهدید کننده حیات دشوار است. همچنین تشخیص سکته قلبی تقریباً در ۲% موارد به اشتباه داده نمیشود که منجر به پیامدهای بالینی مهمی خواهد شد.
تشخیص های افتراقی درد سینه در جول زیر آورده شده است
با توجه به اهمیت درد سینه در مراجعه به اورژانس، در این مقاله برآنیم تا ضمن بررسی نحوه تشخیص و درمان سندرم حاد کرونری، نگرش جدید در مورد پدیدههای آترواسکلروز در بیماران ایجاد نمائیم.
درد حاد قفسه سینه یکی از شایعترین علل مراجعه به بخش اورژانس میباشد. این تظاهر میتواند معرف سکته قلبی (سندرم حاد کرونری (ACS=acute coronary syndrome )) باشد. البته بعد از ارزیابیهای تشخیصی، تنها ۳۰-۱۵% از بیماران با درد حاد قفسه سینه، واقعاً سکته قلبی (سندرم حاد کرونری) دارند. گاهی افتراق بیماران دچار سکته قلبی با دیگر موقعیتهای تهدید کننده حیات (آمبولی ریه، دایسکشن آئورت ، پنوموتراکس خودبخودی و پریکاردیت یا تامپوناد) ، از بیماران دچار درد قفسه سینه غیر قلبی و غیر تهدید کننده حیات دشوار است. همچنین تشخیص سکته قلبی تقریباً در ۲% موارد به اشتباه داده نمیشود که منجر به پیامدهای بالینی مهمی خواهد شد.
تشخیص های افتراقی درد سینه در جول زیر آورده شده است

با پیشرفتهای متعدد اخیر، دقت و کارآیی ارزیابیها را در بیماران درد قفسه سینه افزایش داده که این شامل، بیومارکرهای بهتر جهت تشخیص آسیب میوکارد، دستهبندی بیماران با توجه به ریسک وعوارضشان، تست ورزش زودرس و اسکن رادیونوکلئید برای بیماران کم خطر، CT مولتی اسلایس برای بررسی آناتومی عروق کرونر، آمبولی ریه، دایسکشن آئورت و استفاده از واحدهای درد قفسه سینه (Chest Pain Unit) از جمله راهکارهای کریتیکال جهت ارزیابی فوری و کافی بیماران کم خطر میباشند.
علارغم تمام پیشرفتهای جدید، هنوز هم شرح حال مهمترین ابزار تشخیص برای بیماران با درد سینه میباشد. تشخیص بالینی برای بیمار با درد سینه تیپیک آنژینی در سن آترواسکلروز با نوار قلب نرمال و آنزیم های قلبی نرمال همچنان سندرم حاد کرونری بوده و لازم است بیمار جهت بررسیهای بعدی تحت نظر مانده و ترخیص نگردد.
برطبق دستور العمل ها، بیماران با شک به سندرم حاد کرونری، نباید فقط به صورت تلفنی ارزیابی شوند، بلکه باید به پزشک ارجاع داده شده و از آنها نوار قلب (ECG) دوازده لیدی گرفته شود.
این دستور العمل ها قویا توصیه کردهاند که بیماران با درد قفسه سینه حین استراحت که بیشتر از ۲۰ دقیقه طول بکشد، بیماران با اختلال فشار خون ، سنکوپ اخیر باید سریعاً به بخش اورژانس یا واحدهای تخصصی درد قفسه سینه ارجاع شوند، انتقال توسط وسیله نقلیه شخصی به جای آمبولانس تنها وقتی انجام شود که انتظار باعث تاخیر بیش از ۲۰ تا ۳۰ دقیقهای شود.
این دستور العمل ها قویا توصیه کردهاند که بیماران با درد قفسه سینه حین استراحت که بیشتر از ۲۰ دقیقه طول بکشد، بیماران با اختلال فشار خون ، سنکوپ اخیر باید سریعاً به بخش اورژانس یا واحدهای تخصصی درد قفسه سینه ارجاع شوند، انتقال توسط وسیله نقلیه شخصی به جای آمبولانس تنها وقتی انجام شود که انتظار باعث تاخیر بیش از ۲۰ تا ۳۰ دقیقهای شود.
برطبق دستور العمل ها موارد زیر باید برای ارزیابی بیشتر، سریع ارجاع شوند:
- درد، فشار، سفتی و سنگینی قفسه سینه که به گردن، فک، شانهها و یک یا هر دو بازو انتشار یابد.
- سوزش سردل، تهوع، و یا استفراغ مرتبط با ناراحتی قفسه سینه
- تنگی تنفس حاد و پایدار
- ضعف، سرگیجه، سبکی سر و از دست دادن هوشیاری
- درد، فشار، سفتی و سنگینی قفسه سینه که به گردن، فک، شانهها و یک یا هر دو بازو انتشار یابد.
- سوزش سردل، تهوع، و یا استفراغ مرتبط با ناراحتی قفسه سینه
- تنگی تنفس حاد و پایدار
- ضعف، سرگیجه، سبکی سر و از دست دادن هوشیاری
ارزیابی اولیه شامل شرح حال، معاینه فیزیکی، گرفتن ECG، رادیوگرافی قفسه سینه و اندازهگیری بیومارکرهای آسیب میوکارد، میباشد.
شرح حال در حمله یا سکته های قلبی:
شرح حال در حمله یا سکته های قلبی:
اگربیماران به دلیل کلاپس واقعی یا قریب الوقوع گردش خون یا ناکفایتی تنفسی نیاز به مداخله فوری ندارند، ارزیابی پزشک باید با یک شرح حال بالینی، شامل ارزیابی خصوصیات درد مثل کیفیت، محل انتشار، زمان و سرعت شروع درد (ناگهانی یا تدریجی)، طول علایم، عوامل تشدید کننده و کاهنده درد و هرگونه علایم همراه، مخصوصا علایم گوارشی و ریوی آغاز شود. سندرم حاد کرونری تیپیک اغلب به صورت یک فشار رتوراسترنال گسترده بیان میشود که شروع تدریجی داشته، به بازوها یا فک انتشار دارد، با فعالیت تشدید شده و با استراحت یا نیتروگلیسیرین برطرف میشود.
البته پاسخ به نیتروگلیسیرین، ممکن است یک معیار قابل اعتماد جهت افتراق درد قلبی و غیر قلبی نباشد. برخلاف سرعت شروع تدریجی درد در سندرم حاد کرونری، درد در آمبولی ریه، دایسکشن آئورت و پنوموتراکس، شروع ناگهانی و شدید دارد. درد پلورتیک یا وضعیتی، معرف آمبولی ریه، پریکاردیت، پنومونی یا بیماری عضلانی اسکلتی میباشد.
اما در هر حال و با هر کیفیت درد سینه ، وجود ریسک فاکتورهای آترواسکلروز (مثل سن بالا، جنس مرد، دیابت)، احتمال ایسکمی میوکارد را افزایش میدهند.
درد ممکن است با ورزش ، عصبانیت یا استرس روانی شروع شود، اما سندرم حاد کرونری به طور شایعی بصورت ناگهانی بدون فاکتورهای مستعد کننده آشکار روی میدهد و نباید همیشه بدنبال علت خاصی بود. درد قفسه سینه آتیپیک، احتمال این که علایم، ناشی از آسیب یا ایسکمی میوکارد باشد را کاهش میدهد.
درد با شرایط زیر، مشخصه ایسکمی میوکارد نیست:
- درد پلورتیک (درد تیز و مشابه درد چاقو که با حرکات تنفسی و سرفه ایجاد شود).
- محل اولیه یا تنها محل درد ناحیه میانی یا تحتانی شکم باشد.
درد با شرایط زیر، مشخصه ایسکمی میوکارد نیست:
- درد پلورتیک (درد تیز و مشابه درد چاقو که با حرکات تنفسی و سرفه ایجاد شود).
- محل اولیه یا تنها محل درد ناحیه میانی یا تحتانی شکم باشد.
- دردی که با نوک انگشتان نشان داده شود به ویژه در ناحیه اپکس بطن چپ.
- دردی که به وسیله حرکت دادن یا لمس دیواره قفسه سینه ایجاد شود.
- درد ثابتی که برای ساعتهای زیادی طول بکشد.
- دردهای خیلی کوتاه و مختصر که کمتر از چند ثانیه طول بکشد.
- دردی که به اندامهای تحتانی منتشر شود.
- دردی که به وسیله حرکت دادن یا لمس دیواره قفسه سینه ایجاد شود.
- درد ثابتی که برای ساعتهای زیادی طول بکشد.
- دردهای خیلی کوتاه و مختصر که کمتر از چند ثانیه طول بکشد.
- دردی که به اندامهای تحتانی منتشر شود.
معاینه در حمله ها و سکته های قلبی:
معاینات اولیه بیماران دچار درد قفسه سینه باید به شناسایی علل مستعد کننده ایسکمی میوکارد، مثل فشار خون بالای کنترل نشده، بیماریهای مهم همراه مثل COPD و شواهد عوارض همودینامیکی مانند نارسایی احتقانی قلب، نارسانی میترال جدید و کاهش فشار خون کمک کنند. علاوه بر اندازهگیری علائم حیاتی، معاینه عروق محیطی باید شامل ارزیابی وجود بروئی یا فقدان پالس که مطرح کننده بیماری عروقی خارج قلبی است، باشد. در موارد شک به درد قفسه سینه با علت غیر کرونری، ابتدا باید موارد تهدید کننده حیات مثل دایسکشن آئورت و آمبولی ریه، سپس علل قلبی احتمالی دیگر مثل پریکاردیت یا تامپوناد ، پنوموتوراکس خودبخودی و در نهایت علل غیر قلبی مثل ناراحتی مری( ازوفاژیت) یا معدی-روده ای مدنظر باشند. دایسکش آئورت به وسیله اختلاف پالس یا فشار خون اندام ها، یا به وسیله سوفل جدید نارسایی آئورت، در همراهی با درد پشت و یا خط وسط قدام قفسه سینه، مورد شک قرار میگیرد.
اختلاف در صداهای تنفسی، در حضور تنگی نفس حاد و درد پلوتیک قفسه سینه، احتمال
پنوموتوراکس را افزایش میدهد. تاکیکاردی، تاکی پنه و تشدید جزء پولمونری صدای دوم
قلب (P2)، ممکن است تظاهرات اصلی آمبولی ریه در معاینات فیزیکی باشند.
پنوموتوراکس را افزایش میدهد. تاکیکاردی، تاکی پنه و تشدید جزء پولمونری صدای دوم
قلب (P2)، ممکن است تظاهرات اصلی آمبولی ریه در معاینات فیزیکی باشند.
فاکتورهای متسعد کننده سکته های قلبی:
تا نیمی از بیماران سکته قلبی ، یک فاکتور مستعد کننده یا علایم پرودرم قابل تشخیص دارند.
شواهد نشان میدهد که ورزش سنگین نامعمول و استرس هیجانی میتواند منجر به شروع سکته قلبی شود. این انفارکتوسها به علت افزایش قابل توجه در مصرف اکسیژن میوکارد در حضور تنگی شدید کرونر یا تسهیل پارگی پلاک اترواسکلروتیک روی میدهند.
آنژین تسریع شده یا آنژین حین استراحت دو الگو از آنژین ناپایدارند که ممکن است به سکته قلبی تبدیل شوند.
شواهد نشان میدهد که ورزش سنگین نامعمول و استرس هیجانی میتواند منجر به شروع سکته قلبی شود. این انفارکتوسها به علت افزایش قابل توجه در مصرف اکسیژن میوکارد در حضور تنگی شدید کرونر یا تسهیل پارگی پلاک اترواسکلروتیک روی میدهند.
آنژین تسریع شده یا آنژین حین استراحت دو الگو از آنژین ناپایدارند که ممکن است به سکته قلبی تبدیل شوند.
جراحیهای غیر قلبی نیز به عنوان زمینه ساز حمله قلبی شناخته شدهاند و ارزیابی ریسک قبل از عمل، ممکن است احتمال سکته قلبی و مرگ ومیر مرتبط با آن را کاهش دهد.
کاهش پرفیوژن میوکارد ثانویه به هایپوتنشن (مثل شوک هموراژیک یا شوک سپتیک) و افزایش نیاز به اکسیژن میوکارد به علت تنگی آئورت، تب، تاکیکاردی و بی قرار نیز میتواند مسئول نکرور میوکارد و سکته قلبی باشند.
عفونتهای تنفسی هایپوکسمی به هر علتی، آمبولی ریه، هایپوگلیسمی، تجویز مشتقات ارگوت، استفاده از کوکائین، داروهای سمپاتومیمتیک، بیماری سرم و آلرژی و به ندرت نیش زنبور میتواند فرد را مستعد به سکته قلبی کنند.
ریتم شبانه روزی. بروز سکته قلبی یک ریتم شبانه روزی دارد. پیک بروز سکته قلبی بین ساعات ۶ صبح و ظهر است. این ریتم تحت تاثیر بسیاری از متغیرهای فیزیولوژیک و بیوکمیکال میباشد. ساعات اولیه صبح با افزایش سطح کاتکول آمینها، کورتیزول و افزایش تجمع پلاکتی همراهی دارد. ریتم شبانه روزی در بیمارانیکه تحت درمان با بتابلوکر یا آسپیرین میباشند دیده نمیشود. زمان روز، فصل، استرس و سوانح طبیعی هم در بروز آنفارکتوس میوکارد نقش دارد.
علایم سکته قلبی :
همراه تهوع و استفراغ احتمالاً به علت تحریک واگ یا تحریک گیرندههای بطن چپ به عنوان قسمتی از رفلکس بزولد- جاریش ممکن است روی دهد. این علایم در بیماران با سکته قلبی تحتانی بیشتر رخ میدهد تا سکته قلبی قدامی. تهوع و استفراغ یک عارضه جانبی شایع اپیاتها نیز میباشد. وقتی که درد سکته قلبی به صورت اپی گاستریک و همراه با تهوع و استفراغ باشد ممکن است به راحتی با کله سیستیت حاد، گاستریت یا بیماری زخم معده اشتباه شود. گاهی بیماران در فاز حاد سکته قلبی از اسهال و فوریت در دفع شکایت دارند که نباید با بیماری گوارشی اشتباه شود. علایم دیگر شامل ضعف شدید، سرگیجه، تپش قلب، احساس مرگ قریب الوقوع و تعریق سرد است.
تشخیص افتراقی (سایر تشخیص های ) درد سکته قلبی :
همراه تهوع و استفراغ احتمالاً به علت تحریک واگ یا تحریک گیرندههای بطن چپ به عنوان قسمتی از رفلکس بزولد- جاریش ممکن است روی دهد. این علایم در بیماران با سکته قلبی تحتانی بیشتر رخ میدهد تا سکته قلبی قدامی. تهوع و استفراغ یک عارضه جانبی شایع اپیاتها نیز میباشد. وقتی که درد سکته قلبی به صورت اپی گاستریک و همراه با تهوع و استفراغ باشد ممکن است به راحتی با کله سیستیت حاد، گاستریت یا بیماری زخم معده اشتباه شود. گاهی بیماران در فاز حاد سکته قلبی از اسهال و فوریت در دفع شکایت دارند که نباید با بیماری گوارشی اشتباه شود. علایم دیگر شامل ضعف شدید، سرگیجه، تپش قلب، احساس مرگ قریب الوقوع و تعریق سرد است.
تشخیص افتراقی (سایر تشخیص های ) درد سکته قلبی :
درد سکته قلبی ممکن است تقلید کننده آمبولی ریه (لخته داخل شریان ریه معادل سکته ریوی)، دایسکشن آئورت ( پرگی ناگهانی رگ اصلی بدن)، پنوموتراکس خودبخودی (پاره شدن الوئول ریه و تجمع هوا در بیرون ریه) و پریکاردیت یا تامپوناد( تجمع مایع اطراف قلب و غرق شدن
قلب) ، دردهای گوارشی بویژه اسپاسم منتشر مری یا دردهای عصبی – عظلانی باشد.
قلب) ، دردهای گوارشی بویژه اسپاسم منتشر مری یا دردهای عصبی – عظلانی باشد.
درد پریکاردیت حاد اغلب ویژگی پلورتیک دارد و با حرکات تنفسی و سرفه، شت مییابد و
اغلب به شانه، لبه تراپزیوس و گردن انتشار مییابد. درد ایسکمیک هرگز به لبه تراپزیوس منتشر نمیشود (مشخصه درد پریکاردیت است). درد پلورال معمولا شارپ و شبیه چاقو میباشد و با هر تنفس به صورت سیکلیک شدت آن افزایش مییابد.
درد آمبولی ریه اغلب در قسمت لترال قفسه سینه ایجاد شده، پلورتیک بوده و ممکن است با
هموپتزی همراه باشد.
اغلب به شانه، لبه تراپزیوس و گردن انتشار مییابد. درد ایسکمیک هرگز به لبه تراپزیوس منتشر نمیشود (مشخصه درد پریکاردیت است). درد پلورال معمولا شارپ و شبیه چاقو میباشد و با هر تنفس به صورت سیکلیک شدت آن افزایش مییابد.
درد آمبولی ریه اغلب در قسمت لترال قفسه سینه ایجاد شده، پلورتیک بوده و ممکن است با
هموپتزی همراه باشد.
درد ایجاد شده به وسیله دایسکشن حاد آئورت معمولا در مرکز قفسه سینه لوکالیزه بوده،
بسیار شدید است و به صورت احساس شکاف یا جرخوردگی بیان میشود، که در مدت کوتاهی بعد از شروع به پیک میرسد. این درد برای ساعاتی زیادی باقی میماند، و اغلب به پشت یا اندامهای تحتانی انتشار دارد. معمولا یک یا چند نبض شریانی اصلی لمس نمیشوند.
بسیار شدید است و به صورت احساس شکاف یا جرخوردگی بیان میشود، که در مدت کوتاهی بعد از شروع به پیک میرسد. این درد برای ساعاتی زیادی باقی میماند، و اغلب به پشت یا اندامهای تحتانی انتشار دارد. معمولا یک یا چند نبض شریانی اصلی لمس نمیشوند.
دردی که از مفاصل کوستوکندریال یا کندرواسترنال برمیخیزد با تورم و قرمزی موضعی همراهی دارد، معمولاً شارپ و نیزهای است و با تندرنس واضح لوکالیزه مشخص میشود.

دوره های ناراحتی رترواسترنال ایجاد شده به وسیله اسپاسم منتشر مری در بیماران و همچنین اپی زودهای انقباض مداوم مری میتواند درد سکته قلبی را تقلید کرده و گاهی غیر قابل افتراق باشند.
تظاهرات آتیپیک و سکته قلبی خاموش:
سکته قلبی غیر کشنده میتواند فقط بعد از نوار قلب روتین یا بررسیهای پیش از مرگ تشخیص داده شود. این موارد انفارکتوسهای تشخیص داده نشده، تقریباً نیمی از موارد، واقعاً خاموش هستند و بیمار هیچ علامتی را به خاطر ندارد. نیم دیگر بیماران با انفارکتوس خاموش بعد از این که در الکتروکاردیوگرافی به تشخیص انفارکتوس قبلی رسیدیم، میتوانند علایم منتسب به انفارکتوس حاد میوکارد را به خاطر بیاورند. سکته قلبی تشخیص داده نشده و یا خاموش به طور شایعتری در بیماران بدون آنژین صدری قبلی ، بیماران مسن ، مصرف کنندگان مزمن مسکن های یا مخدر ها و در بیماران با دیابت و هایپرتنشن رخ میدهد. سکته قلبی خاموش اغلب با ایسکمی خاموش دنبال میشود و به نظر میرسد که پروگنوز بیماران با سکته قلبی خاموش مشابه بیماران با سکته قلبی علامتدار باشد.
تظاهرات غیر معمول سکته قلبی شامل موارد زیر است:
۱) تظاهرات نارسایی قلبی (مثل تنگی نفس بدون دردقبلی یا بدتر شدن نارسایی قلبی قبلی بیمار)،
۲) آنژین صدری کلاسیک ولی کوتاه مدت
تظاهرات غیر معمول سکته قلبی شامل موارد زیر است:
۱) تظاهرات نارسایی قلبی (مثل تنگی نفس بدون دردقبلی یا بدتر شدن نارسایی قلبی قبلی بیمار)،
۲) آنژین صدری کلاسیک ولی کوتاه مدت
۳) محل آتیپیک درد، مثل درد گردن یا فک یا دردشانه
۴) تظاهرات سیستم عصبی مرکزی مشابه سکته مغزی ثانویه به کاهش شدید، برون ده قلبی در بیماران با آرترواسکلروز مغزی بعلت شوک یا نارسایی شدید قلبی،
۴) تظاهرات سیستم عصبی مرکزی مشابه سکته مغزی ثانویه به کاهش شدید، برون ده قلبی در بیماران با آرترواسکلروز مغزی بعلت شوک یا نارسایی شدید قلبی،
۵) ضعف قابل توجه، دلهره و عصبی شدن، مانیت یا سایکوز ناگهانی
۶) سنکوپ
۷) سوء هاضمه حاد
 آمبولی های محیطی.
آمبولی های محیطی.
نوار قلب (الکتروکاردیوگرافی = ECG ) در سکته قلبی :
۷) سوء هاضمه حاد
نوار قلب (الکتروکاردیوگرافی = ECG ) در سکته قلبی :
باید طی ۱۰ دقیقه بعد از آمدن بیماری که درد قفسه سینه دارد گرفته شود.
انحرافات جدید قطعه ST به صورت گذرا یا دائم که طی دورههای علامتدار، هنگام استراحت رخ دهد و با برطرف شدن علایم، برطرف شود، نشان دهنده ایسکمی حاد و بیماری حاد کرونری است. اختلالات غیر اختصاصی قطعه ST و موج T که تعریف آنها، افت ST به میزان کمتر از mv 5/0 و یا موج T معکوس mv 2/0 ≥ است، برای دستهبندی خطر، کمتر مفید هستند. یک ECG نرمال در بیماری با سابقه بیماری کرونر، ریسک انفارکتوس میوکارد حدود۴% و بدون سابقه بیماری کرونری حدود ۲% میباشد.
تشخیص محل انفارکتوس بر اساس لید درگیر خواهد بود

همچنین با ECG سریال می توان سیر پیشرفت انفارکتوس میوکارد را پیگیری کرد.
صعود منتشر ST به همراه افت قطعه PR، معرف پریکاردیت است.
انحراف محور به سمت راست، بلوک باندل شاخهای راست، موج T معکوس در تا و الگوی S در لید I به همراه Q و T وارونه در لید III ( S1Q3T3) ، پیشنهاد کننده آمبولی ریه هستند.
در دسترس بودن ECG قبلی، باعث بهبود دقت تشخیصی و کاهش پذیرش بیماران با تراسه پایه غیرطبیعی میشود. ECG سریال، توانایی بالینی برای تشخیص سکته قلبی را افزایش میدهد.
رادیوگرافی قفسه سینهCXR در سکته قلبی:
در همه بیماران با درد قفسه سینه و سکته قلبی ، عکس سینه گرفته میشود. در بیماران با سندرم حاد کرونری اغلب غیر تشخیصی است ولی میتواند ادم ریه به علت اختلال عملکرد دیاستولی و یا سیستولی ناشی از ایسکمی را نشان دهد. برای تشخیص افتراقیهای دیگر مثل دایسکشن آئورت که باعث پهن شدن مدیاستن یا ناب آئورتی میشود، مفید است. در آمبولی ریه، عکس قفسه سینه اغلب نرمال است ولی میتوان آتلکتازی، بالا رفتن همی دیافراگم، افیوژن پلورال یا در مواردی نادرتر Hampton’s Hump یا Westermark’s Sign را نشان دهد.
در همه بیماران با درد قفسه سینه و سکته قلبی ، عکس سینه گرفته میشود. در بیماران با سندرم حاد کرونری اغلب غیر تشخیصی است ولی میتواند ادم ریه به علت اختلال عملکرد دیاستولی و یا سیستولی ناشی از ایسکمی را نشان دهد. برای تشخیص افتراقیهای دیگر مثل دایسکشن آئورت که باعث پهن شدن مدیاستن یا ناب آئورتی میشود، مفید است. در آمبولی ریه، عکس قفسه سینه اغلب نرمال است ولی میتوان آتلکتازی، بالا رفتن همی دیافراگم، افیوژن پلورال یا در مواردی نادرتر Hampton’s Hump یا Westermark’s Sign را نشان دهد.
آنزیم های قلبی در سکته قلبی :
در بیماران با سندرم حاد کرونری احتمالی، باید آنزیم های آسیب میوکارد اندازهگیری شوند. بیومارکر ارجح، تروپونین قلبی T و I (cTnT, cTnI) میباشند و ایزوآنزیم کراتینین کیناز MB (CK- MB) حساست کمتری دارد.
الف) تروپونین: بیومارکر تشخیصی ترجیحی در سکته قلبی بوده برای میوکارد اختصاصیت بالایی دارد و نتایج مثبت کاذب (افزایش تروپونین قلبی در غیاب آسیب میوکارد) آن بسیار نادر است. افزایش تورپونین در غیاب دیگر یافتههای بالینی مطرح کنندهی سکته قلبی ، معمولا نشان دهنده آسیب واقعی میوکارد ناشی از علل غیر آترواسکلروتیک میباشد (مثل میوکاردیت، کوفتگی میوکارد، کاردیوورژن یا دفیبریلاسیون، کشش بطن چپ به علت ناراسایی احتقانی قلب، کریز فشار خون، ورزش شدید، کشش بطن راست به علت آمبولی ریه و علل دیگر هایپرتنشن ریوی حاد).
سطوح مختصر افزایش یافته تروپونینهای قلبی در بیماران با نارسایی کلیوی بدون سکته قلبی نیز گزارش شده است.
ب) ایزوفرم کراتین کیناز MB. محدودیت اصلی آن به عنوان بیومارکر تشخیصی، فقدان نسبی اختصاصیت است، زیرا در ماهیچه اسکلتی، زبان، دیافراگم، روده کوچک، رحم و پروستات هم یافت میشود. با استفاده از اندکس نسبی کراتین کیناز MB ( نسبت کراتین کیناز MB به کراتین کیناز توتال)، محدودیت برای عضله اسکلتی به عنوان منبع، تا حدودی برطرف شده است. در مواردی که تخریب مزمن عضلانی و ترمیم مجدد داریم (مثل دیستروفی عضلانی، ورزشهای شدید مثل دوی ماراتون) یا در تروماهای عضلانی و رابدومیولیز، افزایش سطوح کراتین کیناز MB مشاهده میشود. افزایش سطوح کراتین کیناز MB به ویژه در بیماران بخش اورژانس شایع است، زیرا شرح حال سوء استفاده از الکل و تروما در آنها بالاست. یک برتری کراتین کیناز MB، نیمه عمر کوتاه آن در گردش خون است، که آن را برای ارزیابی زمان رخداد انفارکتوس میوکارد( کمتر از ۲۴ تا ۴۸ ساعت قبل) هم چنین برای تشخیص انفارکت
مجدد، در بیمارانی که در چند روز قبل سابقه انفارکتوس میوکارد داشتهاند مفید میسازد
در حالی که تروپونین تا ۱۴-۱۰ روز بالا می ماند.
مجدد، در بیمارانی که در چند روز قبل سابقه انفارکتوس میوکارد داشتهاند مفید میسازد
در حالی که تروپونین تا ۱۴-۱۰ روز بالا می ماند.
D- دایمر برای رد آمبولی ریه در بیماران با درد قفسه سینه کمک کننده است و یک تست ELISA منفی در بیماران بااحتمال پایین آمبولی، ارزش پیش گویی کننده منفی بیش از ۹۹% دارد ولی در بیمارانی که ظن بالینی بالاست، باید سی تی آنژیوگرافی پولمونری یا اسکن پرفیوژن- ونتیلیشن ریه انجام شود.
اکوکاردیوگرافی
در بیماران با درد قفسه سینه آنژینی با احتمال سکته قلبی ولی با الکتروکاردیوگرافی غیر تشخیصی، یافتن ناحیه با اختلال عملکرد در اکو برای تشخیص ایسکمی کمک کننده است.
اکوکاردیوگرافی در تشخیص دایسکشن آئورت ، آمبولی ریه و تامپوناد هم کمک کننده خواهد بود. یافتن یکد فلپ اینتیمال مربوط به دایسکشن آئورت ، کنترااندیکاسون ماژور برای فیبرینولیتیک تراپی است.
تخمین عملکرد بطن چپ از طریق اکو با آنچه از راه آنژیوگرافی حاصل میشود هماهنگی دارد و
در تعیین پروگنوز بعد از انفارکتوس میوکارد مفید است. به علاوه استفاده زودرس از اکو میتواند در کشف زودرس میوکارد بالقوه قابل حیات ولی Stunncd (حفظ قابلیت انقباضی)، ایسکمی باقی میماند قابل تحریک، بیماران در خطر ایجاد نارسایی احتقانی قلب بعد از انفارکتوس میوکارد و عوارض مکانیکی انفارکتوس میوکارد کمک کننده باشد در بیماران تحت تهویه مکانیکی، اکو نمای ضعیفی دارد و استفاده از اکوترانس ازوفاژیال (TEE) کمک کننده بوده و TEE همچنین قادر به تشخیص دقیقتر نقایص سپتوم بطنی و ارزیابی دقیقتر نارسایی میترال به علت اختلال عملکرد عضله پاپیلری بدنبال ایسکمی میباشد. تکنیکهای داپلر، اجازه ارزیابی جریان خون در حفرات قلبی و امتداد دریچههای قلبی را میدهند و قادر به کشف و ارزیابی شدت نارسایی میترال یا نارسایی تریکوسپید بعد از سکته قلبی خواهد بود. تشخیص محل پارگی سپتوم بطنی و محاسبه میزان شانت و ارزیابی تامپوناد حاد نیز با اکو امکان پذیر است.
در تعیین پروگنوز بعد از انفارکتوس میوکارد مفید است. به علاوه استفاده زودرس از اکو میتواند در کشف زودرس میوکارد بالقوه قابل حیات ولی Stunncd (حفظ قابلیت انقباضی)، ایسکمی باقی میماند قابل تحریک، بیماران در خطر ایجاد نارسایی احتقانی قلب بعد از انفارکتوس میوکارد و عوارض مکانیکی انفارکتوس میوکارد کمک کننده باشد در بیماران تحت تهویه مکانیکی، اکو نمای ضعیفی دارد و استفاده از اکوترانس ازوفاژیال (TEE) کمک کننده بوده و TEE همچنین قادر به تشخیص دقیقتر نقایص سپتوم بطنی و ارزیابی دقیقتر نارسایی میترال به علت اختلال عملکرد عضله پاپیلری بدنبال ایسکمی میباشد. تکنیکهای داپلر، اجازه ارزیابی جریان خون در حفرات قلبی و امتداد دریچههای قلبی را میدهند و قادر به کشف و ارزیابی شدت نارسایی میترال یا نارسایی تریکوسپید بعد از سکته قلبی خواهد بود. تشخیص محل پارگی سپتوم بطنی و محاسبه میزان شانت و ارزیابی تامپوناد حاد نیز با اکو امکان پذیر است.
تخمین سایز سکته قلبی (انفارکتوس قلب) :
با نوار قلب (الکتروکاردیوگرافی): جمع صعود قطعه ST در لیدهای پره کوردیال ، با وسعت آسیب میوکارد در انفارکتوس میوکارد (سکته قلبی) قدامی همخوانی دارد. یک ارتباط بین تعداد لیدهای الکتروکاردیوگرافیک حاوی بالا رفتن قطعه ST و میزان مورتالیته وجود دارد. بیماران با صعود قطعه ST در ۸ یا ۹ لید از ۱۲ لید نسبت به صعود ST در ۲ تا ۳ لید، مورتالیته ۳ تا ۴ برابر دارند. طول دوره ایسکمی که به وسیله مانیتورینگ پیوسته قطعه ST ارزیابی میشود با سایز انفارکتوس، نسبت منطقه انفارکتوس به ناحیه در معرض خطر و وسعت اختلال حرکت ناحیهای دیوارهای بعدی ارتباط دارد.
با مارکرهای سرمی قلب. اندازهگیری سریال پروتئینهای آزاد شده از میوکارد نکروزه در تعیین سایز انفارکتوس میوکارد (سکته قلبی) کمک کننده است. پیک کراتین کیتاز CK- MB یک تخمین تقریبی از سایز انفارکتوس میدهد و ارزش پروگنوستیک دارد. ری پرفیوژن باغث تسریع رسیدن به پیک و همچنین تسریع در شست و شوی مارکرها میشود که مفید بودن این منحنیها را برای تخمین سایز انفارکتوس محدود میکند. اندازهگیری سطوح تروپونین چندین روز بعد از STEMI حتی در موارد با ری پرفیوژن موفقیت آمیز، ممکن است یک تخمین قابل اعتماد از سایز انفارکتوس به دست دهد، زیرا اندازهگیری تاخیری تروپونین، منعکس کننده آزاد شدن تاخیری تروپونین از منطقه نکروتیک میوفیلامان میوکارد آسیب دیده است.
تشخیص بالینی انفارکتوس میوکارد (سکته قلبی) :
تشخیص بالینی انفارکتوس میوکارد نیازمند ارزیابی کامل شرح حال به همراه ترکیبی از شواهد
غیر مستقیم نکروز میوکارد، با استفاده از مودالیتههای بیوشیمایی و الکتروکاردیوگرافیک و تصویربرداری میباشد حساسیت و اختصاصیت ابزارهای بالینی برای تشخیص انفارکتوس میوکارد بسته به مدت زمان بعد از شروع انفارکتوس به میزان قابل ملاحظهای متفاوت است.
غیر مستقیم نکروز میوکارد، با استفاده از مودالیتههای بیوشیمایی و الکتروکاردیوگرافیک و تصویربرداری میباشد حساسیت و اختصاصیت ابزارهای بالینی برای تشخیص انفارکتوس میوکارد بسته به مدت زمان بعد از شروع انفارکتوس به میزان قابل ملاحظهای متفاوت است.
سازمان بهداشت جهانی وانجمن قلب آمریکا حداقل دو مورد از موارد زیر را برای تشخیص
انفارکتوس میوکارد الزامی میدانند: ۱)علایم مشخصه، ۲)تغییرات الکتروکاردیوگرافیک
و ۳)افزایش مارکرهای بیوشیمایی نکروز میوسیت ها.
انفارکتوس میوکارد الزامی میدانند: ۱)علایم مشخصه، ۲)تغییرات الکتروکاردیوگرافیک
و ۳)افزایش مارکرهای بیوشیمایی نکروز میوسیت ها.
علت سکته قلبی :
تقریبا اغلب موارد سندرم حاد کرونری نتیجهای ای پارگی پلاک آترواسکلروز کرونر میباشند
که ترومبوس روی آنها سوار شده است. فرمهای غیر آتروژنیک بیماری عروق کرونر انفارکتوس میوکارد بدون آترواسکلروز کرونر ناشایع هستند.
که ترومبوس روی آنها سوار شده است. فرمهای غیر آتروژنیک بیماری عروق کرونر انفارکتوس میوکارد بدون آترواسکلروز کرونر ناشایع هستند.
پلاک آترواسکلروتیک: در طی سیر طبیعی پلاکهای آترواسکلروتیک، یک تغییر ناگهانی و کاتاستروفیک میتواند اتفاق بیفتد، که با از هم گسیختگی پلاک مشخص میشود. این پارگی پلاک در ارتباط با برخی عوامل خطر محیطی و اکتسابی و نیز عوامل خطر ژنتیکی است. بعضی از بیماران، زمینه سیستمیک به پارگی پلاک دارند که مستقل از ریسک فاکتورهای سنتی است.
پارگی پلاک باعث فعال شدن و تجمع پلاکتی، تولید ترومبین و در نهایت تشکیل ترومبوس میشود. ترومبوس ایجاد شده موجب کاهش جریان خون شده و سرانجام عدم تعادل بین عرضه و تقاضای اکسیژن رخ داده و در صورت شدید و پایدار بودن، منجر به نکروز میوکارد خواهد شد.
پلاکهای آترواسکلروتیک مرتبط با انسداد ترومبوتیک کامل یک شریان کرونری اپیکاردی منجر به
انفارکتوس از نظر ساختار پیچیدهتر و نامنظمتر از آنهایی هستند که با سکته قلبی همراهی ندارند. در مطالعات بافتی اغلب پارگی یا اروزیون این پلاکها مشاهده میشود.همچنین ترکیب ترومبوس ممکن است متفاوت باشد. ترومبوسهای سفید حاوی پلاک، فیبرین یا هر دو و ترومبوسهای قرمز حاوی اریتروسیت، فیبرین، پلاکت و لکوسیت میباشند.
انفارکتوس از نظر ساختار پیچیدهتر و نامنظمتر از آنهایی هستند که با سکته قلبی همراهی ندارند. در مطالعات بافتی اغلب پارگی یا اروزیون این پلاکها مشاهده میشود.همچنین ترکیب ترومبوس ممکن است متفاوت باشد. ترومبوسهای سفید حاوی پلاک، فیبرین یا هر دو و ترومبوسهای قرمز حاوی اریتروسیت، فیبرین، پلاکت و لکوسیت میباشند.
زخم شدگی و پارگی پلاک. در پلاکهای آترواسکلروتیک مستعد به پارگی، میزان آنزیمهایی که ماتریکس خارج سلولی را هضم میکنند، افزایش یافته است. ماکروفاژهای فعال شده و ماست سلها در محل پارگی پلاک در بیمارانی که از STEMI مردهاند زیاد میشوند و میتوانند این پروتنینازها را ترشح کنند. علاوه بر این ویژگیهای ساختاری پلاکهای پر خطر یا آسیبپذیر، استرس القاء شده توسط فشار اینترالومینال، تون وازوموتور کرونر، تاکیکاردی (کشش و ریلاکسیشن دورهای) و پارگی عروق تغذیه کننده در ترکیب با هم، منجر به پارگی پلاک در حاشیه کلاهک فیبروزی نزدیک یک ناحیه مجاور و کمتر درگیر دیواره شریان کرونر (ناحیهی شانهای پلاک) میشوند. تعدادی از متغیرهای فیزیولوژیک کلیدی مانند فشار خون سیستولیک،
ضربان قلب، ویسکوزیته خون، t- PA اندوژن، سطوح PAI-1 ، سطح کورتیزول و اپی نفرین پلاسما، تغییرات فصلی و شبانه روزی دارند و در زمان استرس افزایش مییابند. این عوامل باعث افزایش تمایل پارگی پلاک و ترومبوز کرونری و STEMI در اوایل ساعات صبح، به ویژه در زمستان و بعد از بلایای طبیعی میشوند.
ضربان قلب، ویسکوزیته خون، t- PA اندوژن، سطوح PAI-1 ، سطح کورتیزول و اپی نفرین پلاسما، تغییرات فصلی و شبانه روزی دارند و در زمان استرس افزایش مییابند. این عوامل باعث افزایش تمایل پارگی پلاک و ترومبوز کرونری و STEMI در اوایل ساعات صبح، به ویژه در زمستان و بعد از بلایای طبیعی میشوند.
سندرمهای حاد کرونری
پارگی پلاک باعث آشکار کردن موارد ترومبوژنیک میشود که ممکن است سبب تولید ترومبوس وسیع در رگ مرتبط با انفارکت گردد. وجود کولترال کافی که مانع نکروز شود، میتواند باعث اپی زودهای خاموش انسداد کرونر گردد. انسداد کامل توسط ترومبوس میتواند باعث آسیب ترانس مورال دیواره بطن مشروب شونده از شریان کرونر درگیر و ایجاد صعود قطعه ST در الکتروکاردیوگرافی شود.
ایسکمی ابتدا باعث تغییر توالی دپولاریزاسیون شده و سرانجام تغییرات آن در QRS دیده میشود. شایعترین تغییر مشخصه در QRS در اکثر بیمارانی که در آغاز، صعود قطعه ST داشتند(STEMI) ، ایجاد موج Q در لیدهایی است که روی ناحیه انفارکته قرار میگیرند که منجر به
اصلاح انفارکتوس با موج Q (Q wave MI) میشود در عده اندکی از بیماران که با صعود قطعه ST تظاهر مییابند، موج Q ایجاد نشده، اما اختلالات دیگر در کمپلکس QRS مثل کاهش ارتفاع موج R و خرد شدن (Splintering) و دندانه دار شدن موج QRS به کرات رخ میدهد که به این گروه انفارکتوس بدون موج Q (Non Q wave MI) گویند.
اصلاح انفارکتوس با موج Q (Q wave MI) میشود در عده اندکی از بیماران که با صعود قطعه ST تظاهر مییابند، موج Q ایجاد نشده، اما اختلالات دیگر در کمپلکس QRS مثل کاهش ارتفاع موج R و خرد شدن (Splintering) و دندانه دار شدن موج QRS به کرات رخ میدهد که به این گروه انفارکتوس بدون موج Q (Non Q wave MI) گویند.
بیمارانی که صعود قطعه ST ندارند به عنوان آنژین ناپایدار یا انفارکتوس بدون صعود قطعه ST (NSTEMI) تشخیص داده میشوند. بیماران با صعود پایدار قطعه ST، جهت برقراری جریان خون در شریان اپیکاردی مرتبط با انفارکت، کاندید درمان ری پرفیوژن (دارویی یا با کاتترآنژیوگرافی) میباشند. بیماران با سندرم حاد کرونری که صعود قطعه ST ندارند کاندید دریافت درمان دارویی ری پروفیوژن نمیباشند، اما باید درمان آنتی ایسکمیک بگیرند و سپس آنژیوگرافی و PCI شوند. همه بیماران با سندرم حاد کرونری باید بدون توجه به حضور یا عدم حضور صعود قطعه ST، درمان آنتی کواگولان و ضد پلاکتی دریافت کنند. بنابراین الکتروکاردیوگرافی دوازده لیدی مرکز تصمیمگیری درمانی بیماران دچار سندرم حاد کرونری میباشد.
ملاحضات پروگنوستیک مثل این که آیا تغییرات الکتروکاردیوگرافیک به دلیل اولین انفارکت است
یا ناشی از انفارکتوس میوکارد بعدی، محل انفارکت (قدامی در مقابل تحتانی)، سایز انفارکت و فاکتورهای دموکرافیک مثل سن بیمار باید در کنار فاکتورهای مهم دیگر مورد توجه قرار گیرند.
یا ناشی از انفارکتوس میوکارد بعدی، محل انفارکت (قدامی در مقابل تحتانی)، سایز انفارکت و فاکتورهای دموکرافیک مثل سن بیمار باید در کنار فاکتورهای مهم دیگر مورد توجه قرار گیرند.
عضله قلبی
پاتولوژی کلی: در نگاه کلی، انفارکتوس میوکارد ( سکته قلبی) به دو نوع اصلی تقسیم میشود: انفارکتوس ترانس مورال که نکروز، کل ضخامت (یا نزدیک به کل ضخامت) دیواره بطن را در برمیگیرد و انفارکتوس ساب اندوکاردیال (غیر ترانس مورال) که نکروز، ناحیه ساب اندوکارد، ناحیه اینترامورال میوکارد یا هر دو ناحیه را بدون گسترش به همه دیواره بطن وبه طرف اپیکارد درگیر میکند .
وقتی انفارکتوس، ترانس مورال بوده و در محدوده توزیع یک شریان کرونر منفرد لوکالیزه باشد، ترومبوس انسدادی داخل کرونری بسیار شایعتر است. انفارکتوسهای غیر ترانس مورال، به طور شایعتری در حضور شریان کرونر به شدت تنگ (ولی تا حدی باز) رخ میدهند.
انفارکتوسهای غیر ترانس مورال تکهای، ممکن است ناشی از فیبرینولیز یا PCI روی ترومبوس انسدادی، با برقرای جریان خون قبل از انتشار نکروز از ساب اندوکارد به کل ضخامت دیواره بطنی باشند.
تعدیل تغییرات پاتولوژیک به وسیله ری پرفیوژن: در صورتی که ری پرفیوژن بافت میوکارد که در حال تغییر تکاملی از ایسکمی به سمت انفارکت است، خیلی سریع (در عرض ۲۰-۱۵ دقیقه) انجام شود، میتواند مانع گسترش نکروز گردد و بعد از این مرحله اولیه، تعداد میوسیتها و بنابراین میزان بافت میوکاردی نجات یافته (ناحیه نکروز به ناحیه در خطر) به طور غیر مستقیم به مدت زمان انسداد کامل شریان کرونری، میزان مصرف اکسیژن میوکارد و جریان خون کولترال بستگی دارد .
آناتومی کرونر و محل انفارکتوس :
انفارکتوس ( سکته قلبی ) بطن چپ:
۱-انفارکتوس قدامی (Anterior MI)
2- انفارکتوس تحتانی (Inferoposterior MI) یا انفارکتوس تحتانی خلفی (inferior MI)
3- انفارکتوس لاترال (Lateral MI)
انفارکتوس ( سکته قلبی )بطن راست. تقریبا ۵۰% از بیماران با انفارکتوس تحتانی
میوکارد(Posterior MI) ، درجانی از درگیری بطن راست (RV -MI) و یا ناحیه پوستریور قلب (Posterior MI) را دارند. در میان این بیماران، انفارکتوس بطن راست به ویژه در موارد انفارکتوس ترانس موارل دیواره اینفروپورستریور و قسمت خلفی سپتوم رخ میدهد. انفارکتوس بطن راست به صورت تغییر ناپذیری در همراهی با انفارکتوس سپتوم مجاور و دیواره تحتانی بطن چپ رخ میدهد، اما انفارکتوس ایزوله بطن راست در ۵-۳% موارد مشاهده میشود پس
لازم است از تمام بیماران با تشخیص انفارکتوس تحتانی، لیدهای سمت راست جهت تشخیص
همزمانی با انفارکتوس بطن راست گرفته شود. در صورت همزمانی انفارکتوس بطن راست با
انفارکتوس اینفریور، تجویز نیتراتها کنتراند یکاسیون نسبی داشته و بعلت احتمال هیپوتانسیون ناگهانی، در صورت نیاز مبرم باید با احتیاط بسیار زیاد و تحت مونیتورینگ داده شود.
میوکارد(Posterior MI) ، درجانی از درگیری بطن راست (RV -MI) و یا ناحیه پوستریور قلب (Posterior MI) را دارند. در میان این بیماران، انفارکتوس بطن راست به ویژه در موارد انفارکتوس ترانس موارل دیواره اینفروپورستریور و قسمت خلفی سپتوم رخ میدهد. انفارکتوس بطن راست به صورت تغییر ناپذیری در همراهی با انفارکتوس سپتوم مجاور و دیواره تحتانی بطن چپ رخ میدهد، اما انفارکتوس ایزوله بطن راست در ۵-۳% موارد مشاهده میشود پس
لازم است از تمام بیماران با تشخیص انفارکتوس تحتانی، لیدهای سمت راست جهت تشخیص
همزمانی با انفارکتوس بطن راست گرفته شود. در صورت همزمانی انفارکتوس بطن راست با
انفارکتوس اینفریور، تجویز نیتراتها کنتراند یکاسیون نسبی داشته و بعلت احتمال هیپوتانسیون ناگهانی، در صورت نیاز مبرم باید با احتیاط بسیار زیاد و تحت مونیتورینگ داده شود.
تشخیص انفارکتوس RV باید در تمام بیماران با انفارکتوس تحتانی همراه با فشار خونهای
پایین و ریه پاک (بدون رال) مد نظر قرار داشته باشد.
پایین و ریه پاک (بدون رال) مد نظر قرار داشته باشد.
در صورت هیپوتانسیون، ضمن پرهیز از شروع نیتراتها و یا سایر و ازودیلاتورها، باید با
جبران حجم (مثلا با سرم نرمال سالین) فشار خون در حد حداقل Hg mm 100 حفظ گردد. فشار خون در این بیماران با کاهش فشار پرفیوران کرونری و تشدید ایسکمی همراه خواهد بود.
جبران حجم (مثلا با سرم نرمال سالین) فشار خون در حد حداقل Hg mm 100 حفظ گردد. فشار خون در این بیماران با کاهش فشار پرفیوران کرونری و تشدید ایسکمی همراه خواهد بود.
جریانهای خون کولترال در انفارکتوس ( سکته قلبی ) حاد میوکارد
میزان جریان کولترالهای کرونری، یکی از تعین کنندههای اصلی سایز انفارکت است. در واقع،
بیماران با کولترالهای فراوان میتوانند انسداد کامل کرونر بدون شواهد انفارکتوس در ناحیه توزیع رگ درگیر داشته باشند. بنابراین بقای میوکارد دیستال به چنین انسدادی، تا حدود زیادی وابسته به جریان خون کولترال میباشد. حتی اگر در زمان انسداد کرونر، کولترالها نتوانند مانع انفارکتوس شوند میتوانند سودمندی خود را از طریق ممانعت از تشکیل آنوریسم در بطن چپ نشان دهند. احتمال دارد که حضور تنگی با شدت بالا (۹۰%) با دورههایی از انسداد کامل متناوب، اجازه تشکیل کولترال را بدهد و تا زمانی که انسداد کامل رخ دهد یا برگردد به عنوان مجرای بالقوه عمل میکند.
سپس انسداد کامل این کانالها را به کانال عملکردی کامل تبدیل مینماید، بدون اینکه انفارکتوس بالینی و نکروز عضلانی بارزی ایجاد نماید.
بیماران با کولترالهای فراوان میتوانند انسداد کامل کرونر بدون شواهد انفارکتوس در ناحیه توزیع رگ درگیر داشته باشند. بنابراین بقای میوکارد دیستال به چنین انسدادی، تا حدود زیادی وابسته به جریان خون کولترال میباشد. حتی اگر در زمان انسداد کرونر، کولترالها نتوانند مانع انفارکتوس شوند میتوانند سودمندی خود را از طریق ممانعت از تشکیل آنوریسم در بطن چپ نشان دهند. احتمال دارد که حضور تنگی با شدت بالا (۹۰%) با دورههایی از انسداد کامل متناوب، اجازه تشکیل کولترال را بدهد و تا زمانی که انسداد کامل رخ دهد یا برگردد به عنوان مجرای بالقوه عمل میکند.
سپس انسداد کامل این کانالها را به کانال عملکردی کامل تبدیل مینماید، بدون اینکه انفارکتوس بالینی و نکروز عضلانی بارزی ایجاد نماید.
در موارد زیر، عروق کولترال به خوبی گسترش یافتهاند: ۱) بیماری انسداد کرونر طول کشیده و مزمن به ویژه با کاهش بیش از ۷۵ درصدی سطح مقطع یک یا تعداد بیشتری از عروق اصلی ۲) هایپوکسی مزمن مثل آنمی شدید، بیماری مزمن انسدادی ریوی و بیماری مادرزادی سیانوتیک قلب ۳) هایپرتروفی بطن چپ.
.
علل غیر آترواسکلرونیک انفارکتوس ( سکته قلبی )حاد میوکارد.
پروسههای پاتولوژیک متعددی غیر از آترواسکلروز میتوانند عروق کرونر را درگیر کرده و باعث STEMI شوند. به عنوان مثال انسداد عروق کرونر میتواند به دلیل آمبولی به شریان کرونر باشد. علل آمبولی کرونر متعددند و شامل اندوکاردیت عفونی و اندوکاردیت ترومبوتیک غیر باکتریال، ترومبوس مورال، دریچههای مصنوعی، نئوپلاسم ها، آمبولی هوا در زمان انجام عمل جراحی قلبی و رسوبات کلسیم در زمان دستکاری دریچههای کلسیفیه حین عمل میباشد. ترمبوس درجا در شریانهای کرونر میتواند ثانویه به ترومای دیواره قفسه سینه رخ دهد.
پروسههای مختلف التهابی میتواند مسئول اختلالات عروق کرونر باشند که برخی از آنها
بیماریهای آترواسکلروتیک را تقلید میکنند و ممکن است باعث مستعد شدن به آترواسکلروز واقعی شوند، عفونتهای ویروسی به ویژه ویروس کوکساکی B ممکن است یک علت ناشایع
برای انفارکتوس میوکارد باشد.
بیماریهای آترواسکلروتیک را تقلید میکنند و ممکن است باعث مستعد شدن به آترواسکلروز واقعی شوند، عفونتهای ویروسی به ویژه ویروس کوکساکی B ممکن است یک علت ناشایع
برای انفارکتوس میوکارد باشد.
گاهی ناخوشیهای ویروسی قبل از انفارکتوس میوکارد ( سکته قلبی )در افراد جوان که در آنژوگرافی، عروق
نرمال دارند، دیده میشود. آئورتیت سیفیلیسی میتواند باعث باریک شدگی یا انسداد دهانه
یک یا هر دو کرونر شود، در حالی که آرئریت تاکایاسو میتواند باعث انسداد شریانهای کرونر شود. آرتریت نکروزان، پلی آرتریت ندوزا، بیماری کاوازاکی (سندرم موکوکوتانئوس لنف نود)، لوپوس و آرتریت سلول ژانت همه میتوانند باعث انسداد کرونر شوند.
نرمال دارند، دیده میشود. آئورتیت سیفیلیسی میتواند باعث باریک شدگی یا انسداد دهانه
یک یا هر دو کرونر شود، در حالی که آرئریت تاکایاسو میتواند باعث انسداد شریانهای کرونر شود. آرتریت نکروزان، پلی آرتریت ندوزا، بیماری کاوازاکی (سندرم موکوکوتانئوس لنف نود)، لوپوس و آرتریت سلول ژانت همه میتوانند باعث انسداد کرونر شوند.
سطوح درمانی رادیاسیون مدیاستیتال میتواند باعث آرتریواسکلروز کرونر و انفارکتوس
میوکارد بعدی شود.
میوکارد بعدی شود.
در بیماریهای آمیلوئیدوز، سندرم هورلر، پسودوگزانتوم الاستیکوم و هموسیستیوری، درگیری کرونر و انفاکتوس میوکارد میتواند رخ دهد.
همزمان با افزایش میزان مصرف کوکائین، انفارکتوس میوکارد پس از استفاده از آن رو به افزایش است. کوکائین میتواند در بیماران با عروق کرونر نرمال، انفارکتوس میوکارد قبلی، بیماران با بیماری عروق کرونری ثابت شده و بیماران با اسپاسم کرونر باعث انفارکتوس میوکار شود.
انفارکتوس میوکارد( سکته قلبی ) با عروق کرونر نرمال در آنژیوگرافی
این بیماران جوان هستند، و به جز سابقه مصرف سیگار، ریسک فاکتور کمی داشته و معمولا سابقه آنژین قبل از انفاکتوس میوکارد، ندارند. انفارکتوس در اینها معمولا با علایم پرودروم همراهی ندارد. ولی خصوصیات بالینی، الکتروکاردیوگرافی و آزمایشگاهی اینها از موارد انسداد عروق کرونر به علت آترواسکلروز قابل افتراق نمیباشد.
بیمارانی که بهبود مییابند، اغلب نواحی لوکالیزه از دیس کینزی و هایپوکینزی در آنژیوگرافی
بطن چپ دارند. خیلی از این موارد به علت اسپاسم کرونر و یا ترومبوز هستند، که شاید به علت اختلال عملکرد اندوتلیال زمینهای یا پلاکهای کوچکی باشند که در آنژیوگرافی مشهود نیست. سندرم بالونی شدن گذرای اپکس بطن چپ یا کاردیومیوپاتی Takotsubo به وسیله اختلال حرکت دیوارهای گذرا با درگیری اپکس و ناحیه میانی بطن چپ مشخص میشود.
بطن چپ دارند. خیلی از این موارد به علت اسپاسم کرونر و یا ترومبوز هستند، که شاید به علت اختلال عملکرد اندوتلیال زمینهای یا پلاکهای کوچکی باشند که در آنژیوگرافی مشهود نیست. سندرم بالونی شدن گذرای اپکس بطن چپ یا کاردیومیوپاتی Takotsubo به وسیله اختلال حرکت دیوارهای گذرا با درگیری اپکس و ناحیه میانی بطن چپ مشخص میشود.
این سندرم در غیاب بیماری انسداد کرونز رخ داده و میتواند تقلید کننده انفارکتوسو باشد. یک اپی زود استرس سایکولوژیک اغلب وجود دارد. اتیولوژی آن مشخص نیست ولی متخصصین
بر این باورند که Stunning و اختلال عملکرد میکروواسکولار اعمال شده به وسیله کاتکول آمین،
نقش مهمی ایفا میکنند.
بر این باورند که Stunning و اختلال عملکرد میکروواسکولار اعمال شده به وسیله کاتکول آمین،
نقش مهمی ایفا میکنند.
علل دیگر انفارکتوس میوکارد ( سکته قلبی ) شامل
۱) آمبولی کرونر (ناشی از یک ترومبوس کوچک مورال، دریچه میترال پرولاپس شده یا میگزوم)، ۲) بیماری عروق ریز کرونر که با آنژیوگرافی قابل مشاهده نمیباشند. یا ترومبوس شریان کرونری با ریکانالیزاسیون بعدی، ۳) اختلالات خونی با ترومبوس درجا در حضور شریان کرونری نرمال (مثل پلی سیتمی ورا، بیماری سیانوتیک مادرزادی قلب با پلی سیتمی، آنمی سلول داسی شکل، انعقاد منتشر درون عروقی، ترومبوسیتوز، ترومبوتیک ترومبوسیتوپنیک پورپورا)، ۴) افزایش تقاضای اکسیژن (تیروتوکسیکوز، استفاده از آمفتامینها)، ۵) افت فشار خون (به علت سپسیس ، از دست رفتن خون یا عوامل دارویی)، ۶) اختلالات آناتومیک مثل منشاء آنومال کرونر، فیستول شریانی وریدی کرونری یا Myocardial bridge میباشند.
مدیریت فوری سکته قلبی :
دستور العمل ها جهت تعیین رویکرد پزشک با بیمار، براساس اطلاعات بدست آمده از ۴ بررسی اولیه یعنی شرح و معاینه، نوار قلب و آنزیم های قبلی و رادیوگرافی سینه بیماران را در چهار گروه تشخیصی قرار میدهند. ۱) درد سینه غیر قلبی ۲) سندرم حاد کرونری احتمالی
۳) سندرم حاد کرونری قطعی ۴) درد سینه غیر قلبی با احتمال سایر علل کشنده همانند دایسکشن آئورت، آمبولی ریه، پریکاردیت و پنوموتراکس خود بخودی.
۳) سندرم حاد کرونری قطعی ۴) درد سینه غیر قلبی با احتمال سایر علل کشنده همانند دایسکشن آئورت، آمبولی ریه، پریکاردیت و پنوموتراکس خود بخودی.
ارزیابی فیزیولوژیکی تنگی شریان کرونر:
آیا پس از تشخیص وجود تنگی شریان کرونری، همه تنگیها باید تحت مداخله ری و اسکولاریزاسیون قرار گیرد؟
پاسخ صحیح این سوال، خیر میباشد. ارزیابی فیزیولوژیک شدت تنگی یک جزء اساسی در درمان بیماران آترواسکلروتیک مزمن و حاد میباشد. هر چند تنگی شریانهای اپیکاردی کرونری با افزایش مقاومت عروقی کرونری موجب کاهش پرفیوژن حداکثری میوکارد میتواند باشد اما اولا هر ضایعه انسدادی عروق اپیکاردی از نظر بالینی و کلینیکی مهم نبوده و ممکن است علائم بالینی یا ایسکمی مهمی در قلب بواسطه تامین نیازهای پرفیوژن قلبی از ورای تنگی کرونری یا به کمک عروق کلاترال (که به تدریجبا افزایش تنگی آترواسکلروتیک، از نظر تعداد و قطر افزایش مییابند) ایجاد ننماید.
در چنین شرایطی ری واسکالاریزاسیون با استنت یا جراحی باز بای پس کرونری معمولا سود زیادی به همراه نداشته و فقط خطرات و عوارض اینترونشن را به بیمار تحمیل کند. دوما در برخی موارد علارغم وجود تنگیهای متوسط شراینی اپیکاردی کرونری، ممکن است علائم بیمار بدلیل اختلالات میکروسیرکولاتوری در عروق ریز مقاومتی (عروق داخل میوکاردی)
باشد که در چنین شرایطی علارغم ری واسکولاریزاسیون با استنت با جراحی باز کرونری، علائم بیمار از بین نرفته و باقی میماند. در چنین شرایطی فقط درمان دارویی با هدف بهبود در عملکرد عروق ریز مقاومتی کافی میباشد. اختلال در ذخیره جریان کرونری و یا وازودیلاتاسیون آندوتلیوم بدون وجود ضایع انسادی مهم عروقی کرونری که منجر به علائم بالینی آنژین قلبی بدون یافتن اختلال مهم توجیه کننده در آنژیوگرافی بیماران، در زنان شایعتر از مردان بوده و موید ایسکمی متابولیک میباشد که بر پروگنوز نیز تاثیر منفی دارد. دو مورد از شایعترین فاکتورهای مختل کننده میکروسیرکولاتوری مستقل از شدت تنگی کرونر عبارتند از: هیپرترونی بطن چپ به هر دلیل (از جمله هیپرتانیون مزمن یا اختلالات دریچهای و…) و پاسخ مختل آندوتلیوم به وازویلاتورهای درونی همانند نیتریک اکساید (در زمینه ریسک فاکتورهای عروق کرونری از جمله مصرف سیگار و برخی مواد غذایی پر کلسترول یا مواد توکسیک برای آندوتلیوم و….).
در چنین شرایطی ری واسکالاریزاسیون با استنت یا جراحی باز بای پس کرونری معمولا سود زیادی به همراه نداشته و فقط خطرات و عوارض اینترونشن را به بیمار تحمیل کند. دوما در برخی موارد علارغم وجود تنگیهای متوسط شراینی اپیکاردی کرونری، ممکن است علائم بیمار بدلیل اختلالات میکروسیرکولاتوری در عروق ریز مقاومتی (عروق داخل میوکاردی)
باشد که در چنین شرایطی علارغم ری واسکولاریزاسیون با استنت با جراحی باز کرونری، علائم بیمار از بین نرفته و باقی میماند. در چنین شرایطی فقط درمان دارویی با هدف بهبود در عملکرد عروق ریز مقاومتی کافی میباشد. اختلال در ذخیره جریان کرونری و یا وازودیلاتاسیون آندوتلیوم بدون وجود ضایع انسادی مهم عروقی کرونری که منجر به علائم بالینی آنژین قلبی بدون یافتن اختلال مهم توجیه کننده در آنژیوگرافی بیماران، در زنان شایعتر از مردان بوده و موید ایسکمی متابولیک میباشد که بر پروگنوز نیز تاثیر منفی دارد. دو مورد از شایعترین فاکتورهای مختل کننده میکروسیرکولاتوری مستقل از شدت تنگی کرونر عبارتند از: هیپرترونی بطن چپ به هر دلیل (از جمله هیپرتانیون مزمن یا اختلالات دریچهای و…) و پاسخ مختل آندوتلیوم به وازویلاتورهای درونی همانند نیتریک اکساید (در زمینه ریسک فاکتورهای عروق کرونری از جمله مصرف سیگار و برخی مواد غذایی پر کلسترول یا مواد توکسیک برای آندوتلیوم و….).
گردش خون کولترال کرونری:
بدنبال انسداد قابل توجه یکی از عروق کرونری، قسمتی از پروفیوژن کرونری مورد نیاز بیمار از طریق کانالهای کلاترال کرونری از عروق دیگر تامین شده و مانع ایسیکمی شدید ناحیه مربوط میشود. هر چند پدیده آترواسکروز مزمنتر باشد احتمال تشکیل عروق کلاترال بیشتر است. تشکیل عروق کلاترال با دو مکانیسم آرتریوژنز و آنژیوژنز رخ میدهد. با افزایش شدت تنگی به بیش از ۷۰ درصد و کاهش فشار دیستال کرونری در طی استراحت که در نتیجه با افزایش گرادیان فشاری بین کلاترالهای ریزو عروق مبداء و افزایشShear Stress آندوتلیال در عروق کلاترال که با رشد عروق کلاترال بواسطه نیروهای فیزیکی همراه خواهد بود و نیز در پاسخ به ایسکمی مکرر القا شده بواسطه استرس که منجر به بیان فاکتورهای رشد آندوتلیال عروق( VEGF) میگردد، موجب رشد عروق کلاترال ریز قلبی (آرتریوژنز) و تشکیل عروق کلاترال جدید(آنژیوژنز) خواهند شد.
اگرچه پیشرفتهای قابل توجهی در روند مراقبت از بیماران با سکته قلبی همراه با صعود قطعهST (STEMI) ایجاد شده است، ولی جای پیشرفت بیشتر، بخصوص در گروههای جمعیتی ویژه مثل افراد مسن، زنان، گروههای نژادی خاص و افراد با سطح تحصیلات و موقعیتهای اقتصادی اجتماعی پایین وجود دارد.
به علت کاهش پیشرونده میوسیتهای عملکردی با انسداد پایدار در شریان مرتبط با انفارکت، درمان اولیه باید جهت بازگرداندن جریان خون به ناحیه انفارکته باشد. Primary PCI درمان انتخابی است، که در مراکز با اپراتور مجرب (بیشتر از ۷۵ مورد PCI در سال) و تیم با تجربه (حداقل ۲۰۰ مورد PCI در سال شامل حداقل ۳۶ مورد PCI اولیه در سال) قابل انجام است.
مراقبت قبل از بیمارستان در بیمار با سکته قلبی :
میزان مراقبت قبل از بیمارستان در بیمار مشکوک به انفارکتوس قبلی مستقیما روی بقاء بیماران تاثیر دارد. اغلب مرگهای ناشی از انفارکتوس قلبی در ساعت اول رخ داده و معمولا به علت فیبریلاسیون بطنی میباشد. بنابراین تلاش برای احیای فوری و انتقال سریع بیمار به بیمارستان بسیار مهم میباشد. اجزای اصلی تاخیر، از شروع علایم مرتبط با انفارکتوس حاد میوکارد تا زمان ری پرفیوژن شامل موارد زیر میباشد:
(۱) زمانی که طول میکشد تا بیمار مشکل را تشخیص دهد و به دنبال درمان برود
(۲) ارزیابی، درمان و انتقال قبل از بیمارستان
(۳) زمان مورد نیاز برای ارزیابیهای تشخیصی و شروع درمان در بیمارستان (زمان door-to-needle برای بیمارانی که عوامل فیبریئولیتیک دریافت میکنند و زمان door-to-balloon برای بیمارانی که PCI میشوند)
(۴) زمان شروع درمان تا برگشت جریان خون فاکتورهای مرتبط با بیمار برای زمان طولانیتر مراجعه جهت درمان شامل: سن بالاتر، جنس زن، نژاد سیاه، سطح اقتصادی اجتماعی پایین، آگاهی سوماتیک یا احساس پایین، سابقهای از آنژین، دیابت یا هر دو، مشاوره با نزدیکان و مشاوره تلفنی با پزشک میباشند. متخصصین باید سطح آگاهی بیماران در خطر انفارکتوس قلبی (مثل بیماران با هایپرتنشن، دیابت، سابقه آنژین) را بالا ببرند. بیماران و خویشاوندان آنها باید از مواردی مثل ناراحتی قفسه سینه، خستگی شدید، و تنگی نفس به ویژه در همراهی با تعریق، سبکی سر، تپش قلب یا احساس شوک قریب الوقوع آگاهی داشته باشند و ای مسائل نیازمند پیگیری اوراژانسی برای درمان میباشد. بیماران باید در مواردی که ناراحتی قفسه سینه بیش از ۵ دقیقه طول میکشد، نحوه استفاده از نیتروگلیسرین زیر زبانی را بدانند وفورا با ۱۱۵ تماس برقرار کنند.
سیستم اوراژانس (EMS):
یک پیشرفت مورد انتظار در سیستم EMS، امکان ثبت الکتروکاردیوگرافی دوازده لیدی و انتقال این الکتروکاردیوگرافیها و فعال کردن تیم مراقبل از رسیدن به بیمارستان میباشد تلاشهای رو به پیشرفت برای کوتاه کردن زمان درمان بیماران با انفارکتوس شامل: پوشش گسترده ۱۱۵، قرار دادن دفیبریلاتورهای اتوماتیک اکسترنال (AED) در محلهای عمومی و هماهنگی بیشتر پاسخ آمبولانس EMS میباشد.
یک پیشرفت مورد انتظار در سیستم EMS، امکان ثبت الکتروکاردیوگرافی دوازده لیدی و انتقال این الکتروکاردیوگرافیها و فعال کردن تیم مراقبل از رسیدن به بیمارستان میباشد تلاشهای رو به پیشرفت برای کوتاه کردن زمان درمان بیماران با انفارکتوس شامل: پوشش گسترده ۱۱۵، قرار دادن دفیبریلاتورهای اتوماتیک اکسترنال (AED) در محلهای عمومی و هماهنگی بیشتر پاسخ آمبولانس EMS میباشد.
فیبرینولیز قبل از اعزام بیمار در مراکز درمانی اولیه:
کارآزمایی CAPTIM تمایل به مورتالیتی کمتر را در میان بیمارانی که فیبرینولیز قبل از بیمارستان دریافت کردند در مقایسه با primary PCI نشان داد، به ویژه اگر درمان در ۲ ساعت اول شروع علایم آغاز شود. بیشترین میزان کاهش مورتالیتی وقتی است که ری پرفیوژن در خلال ۹۰-۶۰ دقیقه اول شروع علایم، شروع شود. برقراری تریاژ بخش اورژانس به گونهای که بتوان درمان را در عرض ۳۰ دقیقه آغاز کرد و زمان انتقال از منزل به مرکز بین ۱۵ تا ۳۰ دقیقه باشد بسیار سودمند بوده و ممکن است از تجهیز همه آمبولانسها به امکان فیبرینولیز داخل آمبولانس مقرون به صرفهتر باشد.
اداره بیمار با سکته قلبی در بخش اورژانس:
در زمان ارزیابی بیماران در بخش اورژانس، پزشکان با وظایف مشکلی مثل شناسایی سریع بیمارانی که نیاز به درمان ری پرفیوژن اورژانسی دارند، تریاژ بیماران کم خطرتر به بخشهای مناسب بیمارستان و عدم ترخیص نامناسب بیماران و د رعین حال اجتناب از پذیرشهای غیرضروری روبرو هستند. شرح حال از درد سینه و الکتروکاردیوگرافی دوازده لیدی، ابزار اولیه برای غربالگری بیماران با سندرمهای حاد کرونری در بخش اورژانس میباشند.
بیماران با شرح حال درد سینه در اورژانس سریعا به چهار گروه متفاوت براساس اقدامات تشخیصی و درمانی لازم و مربوطه تقسیم میشوند.
۱) سندرم حاد کرونری با احتمال بسیاربالا(بیش از ۷۵%)
۲) سندرم حاد کرونری احتمالی
۳) درد سینه غیر قلبی
۴) درد سینه غیر آنژینی با احتمال سایر علل کشنده همانند دایسکشن آئورت، آمبولی ریه،
پریکاردیت و پنوموتراکس خود بخودی.
پریکاردیت و پنوموتراکس خود بخودی.
بیماران با سندرم حاد کرونری با احتمال بالا به سه گروه درمانی متفاوت تقسیم میشوند
الف) انفارکتوس میوکارد با صعود قطعه ST (STEMI)
ب) شرح حال ایسکمی قلبی با نزول قطعه ST یاT معکوس
ج) شرح حال ایسکمی قلبی با ECG غیر تشخیصی
صعود قطعه ST در الکتروکاردیوگرافی بیماران با درد آنژین، نشان دهنده انسداد ترومبوتیک شریان کرونر اپیکاردی است و ارزیابی سریع بیمار از نظر کنترااندیکاسیونهای فیبرینولیز و شروع استراتژی ری پرفیوژن را الزامی میکند. از آن جایی که الکتروکاردیوگرافی دوازده لید اساس تصمیم گیری برای شروع ری پرفیوژن است، باید به سرعت و (طی ۱۰ دقیقه یا کمتر) گرفته شود.
به علت این که آریتمیهای کشنده میتوانند به صورت ناگهانی در بیماران با سکته قلبی رخ دهند، همه بیماران باید مانیتور الکتروکاردیوگرافی و لاین وریدی داشته باشند. اگر الکتروکاردیوگرافی اولیه، صعود قطعه ST به اندازه mm1 یا بیشتر در حداقل دو لید مجاور، یا
بلوک شاخهای چپ جدید یا احتمالا جدید را نشان داد، بیمار باید سریعا از نظر شروع ری پرفیوژن ارزیابی شود. فاکتورهای حیاتی که باید به انها دقت نمود تا براساس آن استراتژی ری پرفیوژن را انتخاب کرد شامل موارد زیر میباشند؛
بلوک شاخهای چپ جدید یا احتمالا جدید را نشان داد، بیمار باید سریعا از نظر شروع ری پرفیوژن ارزیابی شود. فاکتورهای حیاتی که باید به انها دقت نمود تا براساس آن استراتژی ری پرفیوژن را انتخاب کرد شامل موارد زیر میباشند؛
(۱) زمانی که از شروع علایم گذشته است
(۲) خطر همراه با STEMI
(3) خطر تجویز فیبرینولیتیک
(۴) زمان لازم برای شروع استراتژی تهاجمی.
با توجه به اهمیت زمان در ری پرفیوژن در سکته قلبی ، معیارهای در سیستم های درمانی برای بررسی کیفیت اجراء مورد استفاده قرار می گیرند از جمله:
زمان door-to-needle کمتر یا مساوی۳۰ دقیقه برای ری پرفیوژن دارویی (ترومبولیز با استرپتوکیناز یا TPA) و زمان door to balloon کمتر یا مساوی ۹۰ دقیقه برای پرفیوژن
آنژیوگرافیک کرونر.
آنژیوگرافیک کرونر.
با افزایش مهارت سیستمهای EMS، میتوان روند اجراء استراتژی ری پرفیوژن را حتی قبل از این که بیمار به بخش اورژانس برسد آغاز کرد. برای بیمارانی که با آمبولانس منتقل میشوند، هدف زمان EMS-to-needle کمتر یا مساوی ۳۰ دقیقه برای شروع فیبرینولیز و زمان EMS-to-balloon کمتر یا مساوی ۹۰ دقیقه برای شروه PCI میباشد.
بیمارانی که الکتروکاردیوگرافی اولیه آنها نزول قطعه ST جدید یا احتمالا جدید و یا موج T معکوس را نشان میدهد، کاندید درمان فیبرینولیز نیستند و باید با این که دید که انژین ناپایدار یا انفارکتوس بدون صعود قطعه ST (NSTEMI یا U/A) دارند.، درمان شوند (افتراق اینها با الکتروکاردیوگرافی سریال و اندازه گیری بیومارکرهای سرمی قلبی مشخص میشود).
در بیماران با شرح حال بالینی پیشنهاد کننده انفارکتوس و الکتروکاردیوگرافی اولیه غیر تشخیصی (عدم انحراف قطعه ST یا T معکوس)، الکتروکاردیوگرافی سریال باید گرفته شده وضمن شروع درمان اولیه بیمار در بخش تحت نظر قرار گیرد. تشخیص اولیه در این گروه از بیماران همچنان سندرم حاد کرونری نوع انفارکتوس قلبی نوع NSTEMI یا آنژین ناپایدار میباشد هرچند نهایتا در گروهی از این بیماران تشخیص نهایی درد غیر قبلی خواهد بود.
اصول کلی درمان دارویی سکته قلبی :
متوقف کردن کسترش ترومبوز (فیزیوپاتولوژی انفارکتوس):
آسپیرین: آسپیرین نه تنها برای پیشگیری اولیه از حوادث عروقی مفید است بلکه در کل طیف سندرمهای حاد کرونری نیز موثر میباشد و قسمتی از درمان اولیه بیماران مشکوک به سکته قلبی میباشد. به علت این که دوز پایین آسپیرین (۸۰ میلی گرم) برای رسیدن به فعالیت ضد پلاکتی کامل نیاز به چند روز زمان دارد. حداقل باید ۳۲۵-۱۶۲ میلی گرم فورا در بخش اورژانس به بیمار داده شود. برای به دستاوردن سریع سطح خونی درمانی، بیماران باید به منظور تسریع جذب از طریق مخاط دهان نسبت به جذب از مخاط معده، قرضها را بجوند.
کنترل درد قلبی
در بیماران با آنژین صدری در بخش اورژانس باید به تخفیف کامل درد توجه ویژه کرد. تمایل به دوز پایین مسکن ها به دلیل ترس از پنهان شدن پاسخ به درمان ری پرفیوژن یا انتی ایسکمیک تصوری غلط است چرا که درد، فعالیت سمپاتیک را در مراحل اولیه انفارکتوس بالاتر میبرد. کنترل درد قلبی با استفاده از ترکیبی از نیتراتها، آنالژزیکها (مثل مورفین)، اکسیژن و در بیماران بدون علائم نارسایی قلبی و بدون ادم ریه بلوک کنندههای گیرنده بتا انجام میشود. به علت این که درد مربوط به STEMI به علت ایسکمی در حال پیشرفت میباشد، مداخلاتی که باعث افزایش عرضه اکسیژن یا کاهش تقاضای آن میشوند قادر به تسکین درد میباشند.
آنالژزیکها: اگرچه عوامل مسکن زیادی مثل مورفین، پنتازوسینو مپریدین برای درمان درد استفاده شده ولی مورفین به جز در مورادیکه افزایش حسایت به این دارو وجود دارد، دارای انتخاب باقی مانده است. یک دوز ۸-۴ میلی گرم از مورفین به صورت داخل وریدی و سپس ۸-۲ میلی گرم در فواصل هر ۵ تا ۱۵ دقیقهای باید تکرار شود تا درد تسکین یابد یا شواهد مسمومیت (هایپوتنشن، سرکوب تنفسی، استفراغ شدید) که مانع تجویز بیشتر دارو میشود مشاهده گردد. کاهش اضطراب در اثر موفین، بیقراری بیمار و فعالیت سیستم عصبی اتونوم و در نتیجه تقاضای متابولیک قلبی را کم میکند. مورفین در بیماران با ادم ریه سودمند است زیرا باعث گشادی وریدها و شریانهای محیطی (به ویژه درموارد فعالیت بیش از حد سمپاتوادرنال) و کاهش کار تنفسی میشودو با کاهش تون سمپاتیک و افزایش تون واگ باعث کاهش ضربان قلب میگردد.
هایپوتنشن به دنبال تجویز نیتروگلیسیرین و مورفین با نگه داشتن بیمار در وضعیت سوپاپن و بالا بردن اندامهای تحتانی به حداقل میرسد. تجویز همزمان آتروپین در دوزهای ۵/۰ تا ۵/۱ میلیگرم به صورت وریدی به ویژه در صورت وجود برادیکاردی و هایپوتنشن قبل از تجویز آن، ممکن است در درمان اثرات واگومیمتیک قابل توجه مورفین سودمند باشد، سرکوب تنفسی در حضور درد شدید یا ادم ریه یک عارضه ناشایع مورفین میباشد، امام وقتی وضعیت قبلی عروقی بیمار بهبود مییابد ممکن است اختلاف تهویه ناگهان نمایان شود. درمان سرکوب تنفسی شامل نالوکسان با دوز اولیه ۱/۰ تا ۲/۰ میلی گرم به صورت وریدی میباشد و در صورت نیاز بعد از ۱۵ دقیقه تکرار میباشد.
نیتراتها: نیتراتهای زیرزبانی به علت توانایی در افزایش جریان خون کرونر از طریق وازودیلاسیون کرونری و کاهش پره لود بطنی برای اغلب بیماران با سندرم حاد کرونری اندیکاسیون دارند. گروهی از بیماران که در آنها نیترات نباید استفاده شود بیماران انفارکتوس میوکارد تحتانی همزمان با انفارکتوس میوکارد بطن راست یا هایپوتنشن قابل توجه (فشار خون سیستولیک کمتر از ۹۰ میلی متر جیوه) به ویژه در همراهی با برادیکاردی، میباشند.در صورت سابقه مصرف سیلدینافیل در طی ۲۴ ساعت قبل ، نیترات ها منع مصرف دارند.
در بدو پذیرش وقتی هایپوتنشن ، انفارکتوس بطن راست در همراهی با انفارکتوس اینفریور و یا سابقه مصرف سیلدینافیل رد شد، باید پرل نیتروگلیسیرین زیر زبانی داده شده و بیمار از نظر بهبود علایم یا تغییرات همودینامیک مانیتور گردد. اگر دوز اولیه خوب تحمل شد و واکنش آلرژیک یا هیپوتانسیون ایدئوسنکراتیک (غیر وابسته به دوز) دیده نشد، نیترات بیشتری با مانیتورینگ علایم حیاتی باید داده شود. توجه کنید که حتی دوزهای کوچک میتواند باعث هایپوتنشن و برادیکاردی ناگهانی ایدئوسنکراتیک شود که میتواند تهدید کننده حیات باشد و معمولا به اسانی با آتروپین داخل وریدی قابل برگشت است.
در بیماران با دورههای طولانی درد سینه افزایش یابنده (Waxing & warning)، نیترات داخل وریدی در کنترل علایم و تصحیح ایسکمی ممکن است کمک کننده باشد ولی نیازمند مانیتور سریال فشار خون میباشد.
در بیماران با دورههای طولانی درد سینه افزایش یابنده (Waxing & warning)، نیترات داخل وریدی در کنترل علایم و تصحیح ایسکمی ممکن است کمک کننده باشد ولی نیازمند مانیتور سریال فشار خون میباشد.
بتابلوکرها: این داروها باعث تسکین درد ایسکمیک، کاهش نیاز به آنالژزیکها و کاهش سایز انفارکتوس و آریتمیهای تهدید کننده حیات میشوند. از تجویز زودهنگام داروهای بتابلوکر به صورت وریدی در بیماران با علائم نارسایی قلب II Killip class یا بیشتر، به علت خطر ایجاد شود کاردیوژنیک باید اجتناب شود. یک پروتکل ایمن برای استفاده از بتابلوکرها شامل موارد زیر است:
۱- ابتدا باید نارسایی قلبی (رال بیشتر از ۱۰ سانتی متر بالای دیافراگرام)، هایپوتنشن (فشار خون سیستولیک کمتر از ۹۰ میلی متر حیوه)، برادیکاردی (ضربان قلب کمتر از ۶۰ تا در دقیقه) یا بلوک دهلیزی بطنی درجه یک (فاصله PR بیشتر از ۲۴/۰ ثانیه) در بیمار رد شود.
۲- متوپرولول در سه دوز ۵ میلی گرمی به صورت بولوس وریدی داده شود.
۳- بیماران بعد از هر بولوس برای ۵-۲ دقیقه تحت نظر قرار گیرند و در صورت کاهش ضربان قلب، کمتر از ۶۰ تا در دقیقه یا فشار خون سیستولیک زیر ۱۰۰ میلی متر جیوه، دوز بعدی داده نشود.
۴- اگر ۱۵ دقیقه بعد از آخرین دوز وریدی، وضعیت همودینامیک پایدار بود، متوپرولول خوراکی به میزان ۵۰ میلی گرم هر ۶ ساعت برای دو روز و بعد از آن ۱۰۰ میلی گرم دوبار در روز تجویز شود.
(ضربان قلب کمتر از ۶۰ تا در دقیقه) یا بلوک دهلیزی بطنی درجه یک (فاصله PR بیشتر از ۲۴/۰ ثانیه) در بیمار رد شود.
در بیماران با کنترااندیکاسیون نسبی دریافت بتابلوکر، انفوزیون یک بتابلوکر بسیار کوتاه اثر مثل اسمولول (۲۵۰-۵۰) ممکن است مفید باشد.
اکسیژن:
هایپوکسی در بیماران با STEMI رخ میدهد و معمولا نتیجه اختلالات ونتیلاسیون- پرفیوژن (به عنوان پیامدی از نارسایی بطن چپ)، پنومونی و بیماری ذاتی ریه میباشد.
هایپوکسی در بیماران با STEMI رخ میدهد و معمولا نتیجه اختلالات ونتیلاسیون- پرفیوژن (به عنوان پیامدی از نارسایی بطن چپ)، پنومونی و بیماری ذاتی ریه میباشد.
در بیمارانی که هایپوکسیک نمیباشند، افزایش کسر اکسیژن در هوای دمی به صورت قابل توجهی باعث افزایش تحویل اکسیژن نمیشود و ممکن است با افزایش مقاومت عروق سیستمیک و افزایش فشار شریانی، حتی مختصری برونده قلبی را کاهش دهد.
بهتر است با پالس اکسی متری، اشباع اکسیژن شریانی را تخمین زد و در صورت نرمال بودن آن، اکسیژن تراپی را حذف کرد. از طرف دیگر، وقتی که از نظر بالینی هایپوکسی شریانی آشکار بوده یا اشباع اکسیژن شریانی کمتر از ۹۰ درصد است، باید اکسیژن تجویز شود. دادن L/min4-2 اکسیژن ۱۰۰ درصد به وسیله ماسک یاکانولای بینی به مدت ۱۲-۶ ساعت، برای اغلب بیماران با هایپوکسی خفیف رضایت بخش است.
محدود کردن سایز انفارکتوس ( سکته قلبی) : سایز انفارکتوس، یک تعیین کننده مهم پروکنوز در بیماران یا SREMI میباشد. بیمارانی که دچار شوک کاردیوژنیک میشوند معمولا یک انفارکتوس منفرد بزرگ یا یک انفارکتوس کوچک یا متوسط سوار شده روی انفارکتوسهای متعدد قبلی دارند.
با توجه به اهمیت پیش اگهی سایز انفارکت، این فرض که تعدیل سایز انفارکت امکان پذیر است، توجهات بالینی و آزمایشگاهی زیادی را به خود جلب کرده است. تلاشها برای کاهش سایز انفارکتوس شامل موارد زیر است:
(۱) ری پرفیوژن زودرس
(۲) کاهش تقاضای انرژی میوکارد
(۳) دستکاری منابع تولید انرژی در میوکارد
(۴) پیشگیری از آسیب ری پرفیوژن.
علی رغم پیشرفتهای زیاد در درمان ری پرفیوژن برای STEMI تصمیم گیری بالینی عملی برای هر فرد کار پیچیدهای است. عدم اطمینان کافی در مورد تعادل سود به زیان (مثل میزان خطر
خونریزی به میزان سود بالینی در بیماران مسن و کسانی که مراجعه تاخیری بعد از شروع
علایم دارند)، فاکتورهای اصلی توجیه کننده استفاده کمتر از حد ری پرفیوژن هستند.
خونریزی به میزان سود بالینی در بیماران مسن و کسانی که مراجعه تاخیری بعد از شروع
علایم دارند)، فاکتورهای اصلی توجیه کننده استفاده کمتر از حد ری پرفیوژن هستند.
درمان ری پرفیوژن
مفهوم کلی. اگرچه ری پرفیوژن خودبخود دیررس در برخی از بیماران اتفاق میافتد، ولی انسداد ترومبوتیک در دسته بزرگی از بیماران با STEMI باقی مانده و باعث ادامه نکروز میوکارد میشود. ری پرفیوژن به موقع میوکارد آسیب دیده، موثرترین راه برقراری تعادل بین عرضه تقاضای اکسیژن میوکاردی و بنابراین کاهش نکروز میوسیت ها است. وابستگی به زمان به ویژه در مورد فیبرینولیز دارویی حیاتی است زیرا با گذشته زمان، ترومبوسهای کرونری رسیده شده و کارآیی فیبرینولیز کاهش مییابد. هر چه بین شروع علایم و انجام PCI فاصله بیفتد، مورتالیتی افزایش مییابد. هر ۳۰ دقیقه تاخیر از شروع علایم تا انجام PCI، ریسک نسبی مورتالیتی یک ساله را ۸ درصد افزایش میدهد.
انتخاب استراتژی ری پرفیوژن علی رغم مدارک قوی و مقالات متعدد، مبنی بر اینکه استفاده سریع از درمان ری پرفیوژن بقاء بیماران با STEMI را بهبود میبخشد، درمان ری پرفیوژن کمتر از حد و اغلب بسیار با تاخیر تجویز میگردد. وقتی درمان ری پرفیوژن به سرعت بعد از بروز علایم انجام شود، PCI اولیه نسبت به ری پرفیوژن دارویی در بیشتر موارد ارجح و در برخی موارد برابراست. نتایج PCI اولیه با توجه به تجربه اپراتور و مرکز انجام آن متفاوت است. چندین نکته در مورد انتخاب نوع درمان ری پرفیوژن باید مد نظر باشد:
(۱) زمان شروع علایم تا شروع درمان ری پرفیوژن. این متغیر مهم پیش گویی کننده سایز انفارکت و پیامد بیماران میباشد. ترومبولیز دارویی بهترین پاسخ را در ساعت اول بروزعلائم داده و بعد از ۶ ساعت از شروع علائم ، فقط در موارد بسیار کم و در شرایط خاص قابل تجویز است. اما درمان مداخله ای آنژیوگرافیک هر چند در ساعات اولیه نتایج بهتری دارد اما در صورت در دسترس نبودن یا مراجعه تاخیری بیماران ، تا ۷۲ ساعت با نتایج رضایت بخشی همراه بوده و در صورت تداوم ایسکمی حتی بعد از این زمان نیز باید انجام گیرد.
(۲) ریسک مرگ بعد از STEMI. بیمارانی که با شوک کاردیوژنیک مراجعه میکنند اگر با رواسکولاریزاسیون زودرس (PCI یا در صورت نیاز بای پس گرافت عروق کرونر) درمان شوند شانس بهبود بقای یک ساله دارند.
(۳) ریسک خونریزی: در بیماران با افزایش ریسک خونریزی به ویژه خونریزی داخل مغزی، PCI
درمان ارجح است. در صورت در دسترس نبودن PCI، سود ری پرفیوژن دارویی باید با خط خونریزی سبک و سنگین شود. وقتی PCI در دسترس نباشد تا زمانی که ریسک
خونریزی تهدید کننده حیات بیشتر از ۴ درصد نباشد، دادن فیبرینولیتیک بهتر از ندادن
آن است.
درمان ارجح است. در صورت در دسترس نبودن PCI، سود ری پرفیوژن دارویی باید با خط خونریزی سبک و سنگین شود. وقتی PCI در دسترس نباشد تا زمانی که ریسک
خونریزی تهدید کننده حیات بیشتر از ۴ درصد نباشد، دادن فیبرینولیتیک بهتر از ندادن
آن است.
در بیمارانی که PCI در دسترس نمیباشد و فیبرینولیز هم کنترااندیکاسیون دارد، ناچار فقط باید آسپیرین و آنتی ترومبین(هپارین ، انوکسپارین و …) باید تجویز شود.
بنابراین، هرگونه تلاش باید برای انجام ری پرفیوژن به کار برده شود، حتی در مواردی که ریسک خونریزی وجود دارد.
(۴) زمان مورد نیاز جهت انتقال به مراکز مجرب PCI: بزرگترین مانع برای اجرای استراتژی PCI روتین، تاخیر برای انتقال به مرکز مجرب PCI میباشد.
اگر تاخیر انتقال به مراکز دارای PCI بیش از یک ساعت (۶۰ دقیقه) باشد، برتری و سودمندی کاهش درمورتالیتی PCI در مقایسه با تجویز عوامل اختصاصی فیبرینولیتیک از دست میرود در کل برای تعیین این نکته اهمیت دارد که آیا فیبرینولیز ارحج است یا استراتژی تهاجمی موارد زیر مد نظر قرار گیرد:
۱- در مورادی که دسترسی آسان به مرکز مجرب PCI فراهم نیست و مراجعه بیمار در کمتر از ۳ ساعت از شروع علایم باشد، فیبرینولیز یا PCI قابل قبول هستند ولی در اغلب موارد، فیبرینولیز ارجح است چرا که انجام PCI اغلب با تاخیر همراه است و بیمار را در معرض خطر آسیب میوکارد قابل توجه قرار میدهد. وقتی فیبرینولیز در مراحل اول داده شود (به ویژه قبل از
بیمارستان در آمبولانس یا در مراکز درمانی اولیه قبل ارجاع بع مرکز سطح بالاتر) و به دنبال آن پس از ارجاع بیمار به مراکز سطح بالاتر و مجهز، آنژیوگرافی تاخیری و در صورت مناسب بودن بیمار، PCI (PCI تسهیل شده )انجام شود، میزان بقای یکساله قابل مقایسه با PCI اولیه میباشد.
بیمارستان در آمبولانس یا در مراکز درمانی اولیه قبل ارجاع بع مرکز سطح بالاتر) و به دنبال آن پس از ارجاع بیمار به مراکز سطح بالاتر و مجهز، آنژیوگرافی تاخیری و در صورت مناسب بودن بیمار، PCI (PCI تسهیل شده )انجام شود، میزان بقای یکساله قابل مقایسه با PCI اولیه میباشد.
۲- وقتی که ریسک سکته قلبی بالا باشد، یک استراتژی تهاجمی PCI اولیه نسبت به فیبرینولیز دارویی ارجح است. این خطر ممکن است مربوط به خود STEMI (شوک کاردیوژنیک، Killip clas مساوی یا بیشتر از II) یا مربوط به خونریزی در نتیجه تجویز فیبرینولیز باشد.
۳- زمانی که یک تیم و اپراتور مجرب PCI در دسترس باشد و بتوان بدون تاخیر استراتژ تهاجمی را به انجام رساند (زمان Door-to-balloon کمتر از ۹۰ دقیقه یا در عرض یک ساعت از زمانی که عامل فیبرینولیتیک میتواند تجویز شود) فرستادن بیمار با STEMI به اتاق کاتتریزاسیون بهتر از تجویز فیبرینولیتیک است.
۴- به علت افزایش خطر خونریزی داخل مغزی با فیبرینولیز در سن بالا، بهتر است بیماران مسن را (به شرط اینکه تاخیر قابل توجهی نداشته باشیم) با PCI درمان کنیم.
۵- وقتی که ترومبوز کرونری با گذشت زمان رسیده میشود، نسبت به فیبرینولیز مقاوم میگردد، بنابراین ، در بیمارانی که بیش از ۳تا ۶ ساعت از شروع علایم مراجعه میکنند (ب شرط اینکه که تاخیر قابل توجهی نداشته باشیم)، PCI ارجح است.
۶- در مورادی که تشخیص مورد شک است استراتژی تهاجمی PCI ارجح است، زیرا نه اطلاعات تشخیصی همزمان با امکان درمان بیمار به ما میدهد، و با خطر خونریزی داخل مغزی در ارتباط با فیبرینولیز نیز همراه نمیباشد.
۷- وقتی که ریسک انفارکتوس پایین باشد، مثل انفارکتوس تحتانی ایزوله (بدون درگیری همزمان بطن راست یا ناحیه خلفی) ، سود استراتژی تهاجمی PCI نسبت به فیبرینولیز دارویی برابر است و بر حسب امکانات مرکز تصمیم گیری می شود.
اثرات درمان فیبرینولیتیک در مورتالیتی بیماران با سکته قلبی:
درمان فیبرینولیتیک هر چقدر زود تجویز شود سودمندتر است و قابل توجهترین نتایج مربوط به تجویز آن در کمتر از ۲ ساعت از شروع علایم میباشد. دادههای مطالعات بزرگی مانند LATE، EMERAS و FTT پایهای برای توجیه درمان فیبرینولیتیک حتی تا ۱۲ ساعت از شروع علایم میباشد هرچند یک ارتباط غیر خطی بین فواید درمان به زمان مشاهده شده و بیشترین سود در طی ۱ تا ۲ ساعت از شروع علایم مشاهده شده است.
اثرات درمان فیبرینولیتیک در مورتالیتی بیماران مسن مورد توجه و مورد بحث است.
موانع شروع درمان فیبرینولیتیک در بیماران مسن با STEMI شامل تاخیر زمانی طولانی جهت دریافت مراقبت پزشکی، میزان کمتر احساس درد ایسکمیک و میزان بیشتر بروزبا علایم آتیپیک و بیماریهای همراه و افزایش موارد الکتروکاردیوگرافی غیر تشخیصی است.
بیماران جوانتر با STEMI نسبت به بیماران مسنتر، با درمان فیبرینولیتیک مختصری کاهش نسبی بیشتر در مورتالیتی دارند اما مورتالیتی مطلق بالاتر در افراد مسنتر باعث کاهش
مورتالیتی مطلق مشابه میگردد. بیماران با انفارکتوس میوکارد تحتانی ریسک مورتالیتی پایینی دارند و گاهی سودمندی درمان با فیبرینولیتیک مورد سوال است ولی در مواردی که
انفارکتوس تحتانی با انفارکتوس بطن راست،( با نزول قطعه ST در لیدهای پره کوردیال یا صعود قطعه ST در لیدهای پره کوردیال لترال همراه باشد)، این بیماران ریسک بالاتری دارند و درمان با ترومبولیتیک ها سود واضحی در کاهش مورتالیته دارد.
مورتالیتی مطلق مشابه میگردد. بیماران با انفارکتوس میوکارد تحتانی ریسک مورتالیتی پایینی دارند و گاهی سودمندی درمان با فیبرینولیتیک مورد سوال است ولی در مواردی که
انفارکتوس تحتانی با انفارکتوس بطن راست،( با نزول قطعه ST در لیدهای پره کوردیال یا صعود قطعه ST در لیدهای پره کوردیال لترال همراه باشد)، این بیماران ریسک بالاتری دارند و درمان با ترومبولیتیک ها سود واضحی در کاهش مورتالیته دارد.
انتخاب داروی ترومبولیتیک در سکته قلبی:
در کل سرعت ری پرفیوژن رگ انفارکته بسیار با اهمیت است و رژیمهای فیبرینولیتیک با قدرت بالا مثل t-PA درمان ترجیحی میباشند. در مواردی که ریسک مرگ پایین است (مثل بیماران جوان با انفارکتوس میوکارد تحتانی کوچک) و ریسک خونریزی داخل مغزی بالاست (مثل هیپرتانسیون حاد)، استرپتوکیناز بعلت خطر خونریزی پایین تر و t-PA بعلت ترومبولیز قویتر، تقریا انتخابهای معادلی هستند و در این مورد استرپتوکیناز بعلت قیمت کمتر بیشتر استفاده می شود.
در بیمارانی که بین ۱۲-۴ ساعت از شروع درد سینه مراجعه میکنند، سرعت ری پرفیوژن رگ انفارکته اهمیت کمتری دارد و استرپتوکیناز و t-PA انتخابهای معادلی هستند ولی هزینه
استرپتوکیناز پایینتر است.
استرپتوکیناز پایینتر است.
در بیمارانی که بین ۱۲-۴ ساعت از شروع علایم مراجعه میکنند و ریسک مورتالیتی پایین ولی ریسک خونریزی داخل مغزی بالا دارند (مثل افراد مسن با انفارکتوس میوکارد تحتانی، فشار خون سیستولیک بیشتر از ۱۰۰ میلی متر جیوه و ضربان قلب کمتر از ۱۰۰ تا در دقیقه)، احتمالا استرپتوکیناز بر t-PA به علت هزینه پایین و احتمال خونریزی کمتر ارجح است.
درمان آنتی کواگولان و آنتی پلاکت در سکته قلبی :
درمان آنتی کواگولان: منطق استفاده از آنتی کواگولان برای پیشگیری از ترومبوس ورید عمیقی، آمبولی ریه، تشکیل ترومبوس بطنی و آمبولیزاسیون مغزی به علاوه تثبیت و حفظ باز بودن رگ انفارکته، بدون توجه به این که بیمار درمان فیبرینولیتیک گرفته باشد یا نه، میباشد.
ترومبوسیتوپنی ناشی از هپارین (HIT) که وابسته به مکانیسم ایمونولوژیک است، نادر بوده و تنها در ۳-۲ درصد از بیماران رخ میدهد. جدیترین عارضه درمان آنتی ترومبوتیک خونریزی به ویژه خونریزی داخل مغزی در همراهی با عوامل فیبرینولیتیک میباشد. حوادث خونریزی دهنده عمده در مواردی مثل سن بالا، وزن پایین، جنس زن، aPTT بسیار طولانی (بیشتر از ۹۰ تا ۱۰۰ ثانیه) و انجام پروسیجر تهاجمی، بیشتر رخ میدهد. چک مرتب aPTT باعث کاهش عوارض خونریزی دهنده ماژور در بیماران درمان شده با هپارین میشود. در طی ۱۲ ساعت اول درمان با فیبرینولیتیک، ممکن است افزایش aPTT ناشی از خود عامل فیبرینولیتیک به تنهایی باشد (به ویژه در صورت تجویز استرپتوکیناز)، که در نتیجه تفسیر دقیق اثرات انفوزیون هپارین بر حالت انعقادی بیمار را مشکل میکند.
رژیم داخل وریدی UFH با بولوس u/kg 60 تا حداکثر u 4000 و به دنبال آن انفوزین u/kg/hr 12 تا حداکثر u/hr 1000 برای ۴۸ ساعت میباشد. انفوزیون پیوسته هپارین کار پر زحمتی است، سطوح غیرقابل اعتمادی از آنتی کواگولاسیون فراهم میکند و نیازمند پایش مکرر aPTT برای تنظیم میزان انفوزین دارد.
اگر بیماران STEMI که با فیبرینولتیک درمان شدهاند نیاز به تجویز آنتی کواگولان برای بیش از ۴۸ ساعت باشد، انوکساپارین یا فونداپارینوکس، ارجح میباشد انوکساپارین در افراد کمتر از ۷۵ سال یک دوز اولیه بولوس ۳۰ میلیگرم به صورت وریدی و به دنبال آن، هر ۱۲ ساعت، mg/kg1 به صورت زیر پوستی داده میشود. در افراد مسنتر از ۷۵ سال، دوز بولوس اولیه حذف شده و دوز نگهدارنده به میزان mg/kg 75/0 هر ۱۲ ساعت زیرپوستی تجویز میگردد. در مواردی که کلیرانس کراتینین کمتر از ml/min30 باشد، دور نگهدارنده باید mg/kg1 هر ۲۴ ساعت میباشد.
درمان آنتی پلاکت. پلاکتها به ویژه در مراحل اولیه تشکیل ترمبوس، یک نقش اصلی در پاسخ به پارگی یک پلاک موجود در عروق کرونر دارند و همچنین پلاکتها در پاسخ به فیبرینولیز هم فعال میشوند و ترومبوسهای غنی از پلاکت نسبت به ترومبوسهای
غنی از فیبرین و اریتروسیت نسبت به فیبرینولیز مقاومترند.
غنی از فیبرین و اریتروسیت نسبت به فیبرینولیز مقاومترند.
بنابراین یک پایه علمی برای مهار تجمع پلاکت در تمامی بیماران STEMI بدون توجه به استراتژی درمانی ری پرفیوژن، وجود دارد. بیماران در ریسک برای STEMI، بیماران با STEMI اثبات شده قبلی و بیماران در فاز حاد STEMI، با درمان آنتی پلاکت، حدود ۲۲ درصد کاهش در ترکیب مرگ، انفارکتوس میوکارد راجعه غیر کشنده و سکته مغزی غیر کشنده مشاهد میشود. سودمندی مطلق، در بیماران با ریسک بالا بیشتر است.
علی رغم مهار سیکلواکسیژناز به وسیله آسپیرین، فعال شدن پلاکت توسط مسیرهای مستقل از ترومبوکسان ادامه یافته و منجر به تجمع پلاکت، و افزایش تشکیل ترومبین میشود. ثابت شده که اضافه کردن عوامل ضد پلاکتی دیگر به آسپیرین، اثرات مفید در بیماران STEMI دارد. مهار کنندههای گیرنده ADP به جلوگیری از فعال شدن و تجمع پلاکت در این موارد کمک میکند. همه بیماران با STEMI (البته در صورتی که کنترااندیکاسیونی نداشته باشند)باید تا جایی که ممکن است هر چه زودتر آسپیرین به همراه کلوپیدوگرل دریافت کنند و دادن این ترکیب حتی قبل از شروع فیبرینولیز با استرپتوکیناز یا TPA ضروری است. اضافه کردن کلوپیدوگرل به آسپیرین در بیمارانی که تحت PCI اولیه بعد از STEMI قرار میگیرند، الزامی بوده و علاوه بر سود معمول در STEMI ، موجب کاهش ترومبوز داخل استنت نیز می شود.
در بیماران STEMI که تحت PCI اولیه یا PCI تاخیری بعد از درمان اولیه STEMI قرار میگیرند، داروی قویتر مهار کننده ADP یعنی پراسوگرل نسبت به کلوپیدوگرل، در کاهش ریسک مرگ قلبی عروقی، انفارکتوس میوکارد و سکته مغزی ارجحیت دارد.
توصیهها برای درمان آنتی پلاکت در سکته قلبی:
آسپیرین فاقد پوشش رودهای در بیمارانی که قبل از بروز STEMI آسپیرین مصرف نمیکردند، باید جویده شود. دوز اولیه باید ۳۲۵-۱۶۲ میلی گرم باشد. در طی فاز نگهدارنده، دور آسپیرین باید به میزان ۱۶۲-۷۵ میلی گرم روزانه کاهش یابد تا ریسک خونریزی به حداقل برسد. در صورت حساسیت واقعی به اسپیرین، عوامل آنتی پلاکت دیگر مثل کلوپیدوگرل (دوز لودینگ ۶۰۰-۳۰۰ میلی گرم و دوز نگهدارنده ۷۵ میلی گرم در روز) میتواند جایگزین شود. ولی اضافه کردن آسپیرین برای کلوپیدوگرل همه بیماران با STEMI در صورتی که کنترااندیکاسیونی نداشته باشند، توصیه شده است.
دوز لودینگ کلوپیدوگرال به میزان ۳۰۰ میلی گرم برای بیماران جوانتر از ۷۵ سال که فیبرینولیتیک دریافت کردهاند باید تجویز شود. در مورد دادن دوز لودینگ به افراد ۷۵ ساله یا مسنتر که فیبرینولیتیک گرفتهاند، اطلاعات کافی وجود ندارد. وقتی که تصمیم به انجام PCI
اولیه وجود دارد، دوز لودینگ خوراکی به میزان ۶۰۰-۳۰۰ میلی گرم از کلوپیدوگرل قبل از تعبیه استنت، لازم است. براساس نتایج کارآزمایی تجویز پراسوگرل با یک روز لودینگ خوراکی ۶۰ میلی گرم و درمان نگهدارنده روزانه ۱۰ میلی گرم یک جایگزین ارجح نسبت به کلوپیدوگرل ۳۰۰ میلی گرمی میباشد(برای بیمارانی که در ریسک خونریزی تهدید کننده حیات نمیباشند، مثل سابقه بیماری عروق مغزی). متشابهاً تجویز ticagrelor با یک دوز لودینگ ۱۸۰ میلی گرم و درمان نگهدارنده ۹۰ میلی گرم دوبار در روز بر کلوپیدوگرل برتری دارد.
اولیه وجود دارد، دوز لودینگ خوراکی به میزان ۶۰۰-۳۰۰ میلی گرم از کلوپیدوگرل قبل از تعبیه استنت، لازم است. براساس نتایج کارآزمایی تجویز پراسوگرل با یک روز لودینگ خوراکی ۶۰ میلی گرم و درمان نگهدارنده روزانه ۱۰ میلی گرم یک جایگزین ارجح نسبت به کلوپیدوگرل ۳۰۰ میلی گرمی میباشد(برای بیمارانی که در ریسک خونریزی تهدید کننده حیات نمیباشند، مثل سابقه بیماری عروق مغزی). متشابهاً تجویز ticagrelor با یک دوز لودینگ ۱۸۰ میلی گرم و درمان نگهدارنده ۹۰ میلی گرم دوبار در روز بر کلوپیدوگرل برتری دارد.
اقدمات لازم در طی بستری CCU
حفظ آرامش بیمار: پرسنل CCU باید نسبت به نگرانی بیمار در مورد مورتالیتی، پروگنوز و قدرت کارکرد بعدی حساس باشند. یک جو آرام و برقراری ارتباط نزدیک با بیمار و اطمینان بخشیدن وی، باعث کاهش اضطراب و کاهش تون سمپاتیک شده و منجر به کاهش هیپرتانسیون، تاکیکاردی و آریتمی میشود.
رژیم غذایی در سکته قلبی : برای کاهش ریسک تهوع و استفراغ بعد از انفارکتوس و کاهش خطر اسپیراسیون، طی ۱۲-۴ ساعت اول پذیرش، بهتر است بیمار چیزی نخورد و یا رژیم مایعات صاف شده، دریافت کند. سپس رژیم با ۵۵-۵۰ درصد کالری از کربوهیدراتهای پیچیده، و تا ۳۰ درصد از چربیهای غیر اشباع و اشباع مونو باید شروع شود. رژیم باید غنی از غذاهای با پتاسیم، منیزیم و فیبر بالا ولی سدیم پایین باشد.
ضد اضطرابها و خواب آورها در سکته قلبی :
اگزازپام خوراکی تا چهار بار در روز، برای کاهش اضطراب طی ۲۴ تا ۴۸ ساعت اول مفید است. دلیریوم ممکن است با داروهای ضد آریتمی، بلوکرها، نارکوتیکها و بتابلوکرها رخ دهد. این
داروها در بیماران با وضعیت ذهنی غیر طبیعی باید قطع شوند. هالوپریدول میتواند در بیماران با STEMI، با دوز ۲ میلی گرم وریدی برای بیماران با بی قراری خفیف و دوز ۱۰-۵ میلی گرم برای بی قراری شدید تجویز شود. خواب آورها مثل تمازپام (۱۵ تا ۳۰ میلی گرم) یا معادل آن میتوانند در صورت نیاز برای خوابیدن استفاده شوند.
داروها در بیماران با وضعیت ذهنی غیر طبیعی باید قطع شوند. هالوپریدول میتواند در بیماران با STEMI، با دوز ۲ میلی گرم وریدی برای بیماران با بی قراری خفیف و دوز ۱۰-۵ میلی گرم برای بی قراری شدید تجویز شود. خواب آورها مثل تمازپام (۱۵ تا ۳۰ میلی گرم) یا معادل آن میتوانند در صورت نیاز برای خوابیدن استفاده شوند.
داروهای ملین مثل Docusate به میزان ۲۰۰ میلی گرم روزانه یا دیگر نرم کنندههای مدفوع باید
برای جلوگیری از یبوست و زور زدن (مانور والسالوا) مورد استفاده قرار گیرند.
برای جلوگیری از یبوست و زور زدن (مانور والسالوا) مورد استفاده قرار گیرند.
فعالیت فیزیکی بعد از سکته قلبی :
در غیاب عوارض، بیماران با STEMI، نیاز به استراحت در بستر بیشتر از ۱۲ ساعت ندارند مگر این که از نظر همودینامیک اختلال داشته باشند. پیشرفت فعالیت باید براساس وضعیت بالینی، سن بیمار و ظرفیت فیزیکی باشد. در بیماران بدون اختلال همودینامیک، به حرکت درآوردن زودرس بیمار شامل آویزان کردن پاها از لبه تخت، نشستن روی صندلی، ایستادن و قدم زدن اطراف تخت بلامانع است.
درمان دارویی در سکته قلبی:
بتابلوکرها. اثرات بتابلوکرها درمان بیماران STEMI به دو دسته تقسیم میشود، فوری (زمانی که دارو در سیر اولیه انفارکتوس داده میشود) و بلندمدت (پیشگیری ثانویه). تزریق فوری داخل وریدی این داروها باعث کاهش اندکس قلب، ضربان قلب و فشار خون میشود. اثر خالص آن، کاهش مصرف اکسیژن میوکارد در دقیقه و به ازای هر ضربه میباشد. اثرات مطلوب تجویز حاد داخل وریدی بتابلوکر در تعادل عرضه و تقاضای اکسیژن به صورت کاهش درد قفسه سینه و کاهش ایجاد آریتمیهای بطنی و کاهش میزان حوادث ایسکمیک راجعه میگردد ولی خطر بالقوه شوک کاردیوژنیک وجود دارد. در بیماران بدون کنترااندیکاسیون، باید به سرعت بتابلوکرهای خوراکی دریافت کنند. استفاده زودرس از بتابلوکرهای داخل وریدی هم به ویژه در صورت وجود هایپرتنشن یا تاکی آریتمیها منطقی به نظر میرسد. (در غیاب علایم نارسایی قلبی یا برونده پایین، افزایش ریسک شوک کاردیوژنیک، نشانههای ریسک بالا برای ایجاد شوک کاردیوژنیک و دیگر کنتراندیکاسیونهای نسبی بتابلوکرها). متوپرولول ۵ میلی گرم به صورت داخل وریدی هر ۲ تا ۵ دقیقه تا سه دوز به شرطی که ضربان قلب به کمتر از ۶۰ ضربه در دقیقه و فشار خون سیستولیک به کمتر از ۱۰۰ میلی متر جیوه نرسد، استفاده میشود. دوز نگهدارنده خوراکی ۵۰ میلی گرم هر ۶ ساعت برای ۲ روز و سپس ۱۰۰ میلی گرم دو بار در روز میباشد. بتابلوکرها به ویژه در صورت وجود درد ایسکمیک راجعه یا مداوم، افزایش تکرار شونده یا پیشرونده سطح مارکرهای سرمی نکروز که نشانه گسترش انفارکت است یا وجود تاکی آریتمیهای زودرس بعد از شروع انفارکتوس مفید میباشند. به جز در مواردی که کنترااندیکاسیون وجود دارد، بتابلوکر باید برای دراز مدت در بیماری با STEMI ادامه پیدا کند بیمارانی که در مراحل اول، برای بتابلوکرها کنترااندیکاسیون داشتند (مثلا نارسایی قلبی)، باید مجددا بعد از ۲۴ ساعت از نظر امکان شروع بتابلوکرها ارزیابی شوند.
با توجه به اثرات سودمند زیاد ، گاهی ممکن است حتی با وجود کنترااندیکاسیون نسبی برای بتابلوکر مثل سابقه آسم خفیف و کنترل شده، برادیکاردی خفیف تا حد ۵۰ در دقیقه یا بالاتر، نارسایی قلبی خفیف و کنترل شده و پایدار یا بلوک درجه یک قلبی درمان با این داروها ادامه یابد.
مهار کنندههای سیستم رنین- آنژیوتنسین- آلدوسترون (RAAS): اثرات مهار ARRS، شامل تاثیر مطلوب روی ریمودلینگ بطنی، همودینامیک و کاهش نارسایی احتقانی قلب میباشد.
کنترااندیکاسیونهای ماژور استفاده از ACEI ها در STEMI شامل هایپوتانسیون، هیپرکالمی،
افزایش حساسیت شناخته شده و حاملگی میباشند. عوارض جانبی شامل هایپوتانسیون (به ویژه بعد از اولین دوز)، سرفه مزمن و به میزان کمتر آنژیوادم هستند.
افزایش حساسیت شناخته شده و حاملگی میباشند. عوارض جانبی شامل هایپوتانسیون (به ویژه بعد از اولین دوز)، سرفه مزمن و به میزان کمتر آنژیوادم هستند.
توصیههای کلی
بعد از تجویز آسپیرین و شروع استراتژیهای ری پرفیوژن و بتابلوکرها در صورتی که مناسب باشند، در همه بیماران با STEMI باید مهار RAAS در نظر گرفته شود. اگر چه عدم توافق کمی در مورد تجویز طولانی مدت ACEI ها برای بیماران با ریسک بالا وجود دارد (مانند افراد مسن، انفارکتوس قدامی، سابقه انفارکتوس قبلی، نارسایی قلبی کلیپ کلاس II یا بیشتر و بیماران بدون علامت با شواهد افت عملکرد گلوبال بطن در مطالعات تصویربرداری)، اما تجویز کوتاه مدت (۴ تا هفته) برای گروه وسیعی از بیماران که این ریسک فاکتورها را ندارند پیشنهاد شده
است.
است.
از آنجا که ARB ها حداقل به اندازه ACEI ها در کاهش مورتالیتی و سایر پیامدهای قلبی عروقی نامطلوب به دنبال انفارکتوس موثر هستند میتواند به عنوان یک جایگزین برای STEMI در نظر گرفته شوند.
نیتراتها در سکته قلبی :
نیتروگلیسیرین زیر زبانی اگرچه باعث کاهش فشارهای پرشدگی بطن چپ، کشش دیواره کاهش کار قلبی و بهبود جریان خون کرونر به ویژه در ناحیه ایسکمیک شده وتاحدی اثرات ضد
پلاکتی دارد اما به ندرت شریان مسدود کرونر را باز میکند.
نیتروگلیسیرین زیر زبانی اگرچه باعث کاهش فشارهای پرشدگی بطن چپ، کشش دیواره کاهش کار قلبی و بهبود جریان خون کرونر به ویژه در ناحیه ایسکمیک شده وتاحدی اثرات ضد
پلاکتی دارد اما به ندرت شریان مسدود کرونر را باز میکند.
در بیماران با STEMI، تجویز نیتراتها باعث کاهش فشار گوهای مویرگی ریه، کاهش فشار شریانی سیستمیک، کاهش حجم حفره بطن چپ، کاهش سایز انفارکتوس و کاهش بروز عوارض مکانیکی میشوند. نیتروگلیسیرین داخل وریدی به نظر بیشترین سودمندی را در مراحل اولیه شروع علایم دارد. ما نیتراتها روی مورتالیتی کوتاه مدت تاثیری ندارند.
ترکیبات نیترات و روش تجویز
نیتروگلیسیرین داخل وردیدی را میتوان به صورت ایمن در بیماران انفارکتوس در حال تکامل، تا وقتی که رفلکس تاکیکاردی و هایپوتانسیون شریانی سیستمیک ایجاد نشود، افزایش دوز داد. بیماران با انفارکتوس دیواره تحتانی به ویژه با درگیری همزمان بطن راست، به افت پره لود ناشی از ونودیلاسیون حساس هستند. در این موارد، ونودیلاسیون القاء شده با نیتراتها باعث هایپوتانسیون شدید سیستمیک، نقص برون ده قلبی و کاهش جریان خون کرونر شده و بنابراین ایسکمی میوکارد را بدتر میکند.
یک رژیم منطقی برای نیتراتها شروع انفوزیون با دو با افزایش میباشد تا این که فشار متوسط شریانی در بیماران نرموتنسیو، حدود ۱۰ درصد و در بیماران هایپرتنسیو، حدود ۳۰ درصد کاهش پیدا کند ولی در هیچ موردی فشار خون شریانی به زیر ۹۰ ملی متر جیوه نرسد.
عوارض جانبی
مت هموگلوبینمی قابل توجه از نظر بالینی در بیمارانی که در حال دریافت نیتروگلیسیرین داخل وریدی هستند، گزارش شده است. این عارضه معمولا با دوزهای غیر معمول بالای نیتروگلیسیرین رخ داده و البته ناشایع میباشد. مت هموگلوبینمی، نه فقط باعث ایجاد علایمی مثل لتارژی و سردرد میشود بلکه افزایش سطح مت هموگلوبین میتواند ظرفیت حمل اکسیژن توسط خون را مختل کند و باعث تشدید ایسکمی شود.
تحمل به نیتروگلسیرین داخل وریدی (که باعث نیاز به افزایش دوز میشود)، در بسیاری از بیماران و اغلب به سرعت و در ۱۲ ساعت اول شروع دارو اتفاق میافتد بنابراین در صورت عدم اجبار بالینی از تجویز مداوم نیترات ها باید پرهیز کرد.
توصیه برای استفاده از نیتراتها در بیماران با سکته قلبی
نیتروگلیسیرین برای تسکین درد پایدار و به عنوان یک ونودیلاتور و وازودیلاتور و کاهنده پره لود و افترلود در بیماران با اختلال عملکرد بطن چپ ناشی از انفارکتوس، اندیکاسیون دارد. در غیاب آنژین راجعه یا نارسایی احتقانی قلب، به صورت روتین نیتراتها را تجویز نمیکنیم. بیماران با ریسک بالا مثل موارد انفارکتوس بزرگ به ویژه در دیواره قدامی، از نیتراتها برای کاهش ریمودلینگ بطن بیشترین نفع را میبرند و منطقی است که نیترات داخل وریدی به مدت ۴۸-۲۴ ساعت در این بیماران تجویز شود. سودمندی واضحی از درمان طولانی مدت نیتراتها در بیماران بدن علامت مشاهده نشده است. بنابراین ما نیتراتها را بعد از ۴۸ ساعت تجویز نمیکنیم مگر این که آنژین یا نارسایی بطنی وجود داشته باشد.
استاتین ها:
استاتین ها در تمام بیماران سندرم حاد کرونری ونیز آنژین پایدار مزمن با هدف LDL کمتر از ۱۰۰ و ترجیحا کمتر از ۷۰ تجویز می گردد.
آنتاگونیستهای کانال کلسیم: علی رغم شواهد بالینی و آزمایشگاهی اثرات آنت ایسکمیک، این داروها در فاز حاد STEMI مفید نمیباشند و نگرانی در مورد افزایش مورتالیتی با اشکال کوتاه الاثر این داروها (مثل نیفدیپین) وجود دارد.
درمانهای دیگر در سکته قلبی :
منیزیم و پتاسیم و گلوکز
در همه بیماران با STEMI در بدو ورود باید پتاسیم و منیزیم اندازهگیری شود. لازم است کمبود منیزیم جایگزین شود تا سطح سرمی منیزیم به ۲ میلی اکی والان در لیتر یا بیشتر برسد. در هایپوکالمی (پتاسیم کمتر از ۴ میلی اکیوالان در لیتر) در طی دوره درمان STEMI، ضمن اصلاح کمبود پتاسیم، سطح منیزیم سرم باید مجدد چک شده و در صورت لزوم جایگزین گردد، زیرا در صورت وجود هایپومنیزیمی، تصحیح پتاسیم سرم مشکل میباشد. اپی زودهای torsades depoint باید با یک بولوس یک تا دو گرمی منیزیم طی ۵ دقیقه درمان شود. اندیکاسیونی برای تجویز روتین منیزیم داخل وریدی در بیماران با STEMI وجود ندارد.
سطح گلوکز باید به صورت روتین موقع بستر در CCU برای همهی بیماران اندازه گیری شوند. انفوزیون انسولین برای درمان هایپرگلیسمی همراه قطع متفورمین در بیماران با STEMI توصیه شده است.
دیورتیکها. نارسایی قلبی خفیف در بیماران با STEMI به خوبی به دیورتیکهایی مثل فوروزماید داخل وریدی در دوزهای ۴۰-۱۰ میلی گرم و تکرار هر ۴-۳ ساعت در صورت نیاز، جواب میدهد.




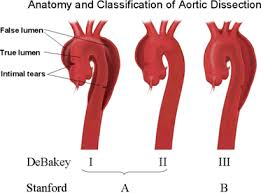

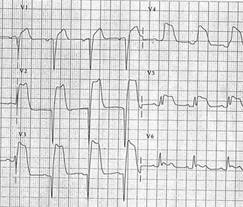
مرداد ۲۶, ۱۳۹۳ در t ۱۰:۱۶ ·
عالی بود
مرداد ۲۶, ۱۳۹۳ در t ۲۲:۵۵ ·
با سلام
چکار کنیم سکته قلبی نکنیم؟
مرداد ۲۶, ۱۳۹۳ در t ۲۳:۰۰ ·
سلام. مطلب زیاد است. لطفا از لینک پیشگیری از بیماری های قلبی کل مطلب را مطالعه و در صورت نیاز سوال فرمایید. متشکرم. http://galb.ir/archives/135
آبان ۴, ۱۳۹۳ در t ۲۲:۰۲ ·
سلام. بنظرم باید خودتان آماده کنید. تا حالا پوستر آموزشی آنچنانی من ندیدم
آذر ۱۰, ۱۳۹۳ در t ۲۲:۰۶ ·
با سلام
آیا ماهیچه های دچار انفارکتوس به حالت طبیعی بر می گردند؟
دی ۶, ۱۳۹۳ در t ۲۱:۳۰ ·
سلام. سلولهای قلب و مغز انسان قادر به بازسازی نبوده و بعد نکروز و مرگ سلولی با سلولهای غیر عملکردی کلاژن جایگزین می گردند.
دی ۲۷, ۱۳۹۸ در t ۱۸:۳۵ ·
یکی از اسباب بوجود آوردنده مایوکارد انفرکتوس سن گفته شده یعنی باید اشخاص کهن سال زیاد تر مصاب شوه اما مه خودم ده شفاخانه بخاطر کار های عملی میروم و همراه مریض های سر میخورم که سن شان غیر قگابل تصور است ولی به ای تکلیف دچار استن خلاصه کلام چرا در اشخاص جوان هم بوجود میایه دلیل اصلی چیست محترم؟؟؟
دی ۲۷, ۱۳۹۸ در t ۲۳:۳۶ ·
سلام
با افزایش سن ریسک انفارکتوس بیشتر می شود ولی در تمام سنین حتی جوانان نیز رخ میدهد اما با احتمال کمتر.